
La velocidad de reacción
Antecedentes
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?


La velocidad de reacción o la tasa de reacción para una reactivo o en un producto particular, la reacción se define como intuitivamente qué tan rápido tiene lugar una reacción. Por ejemplo, el oxidación del hierro bajo la atmósfera es una reacción lenta que puede tardar muchos años, pero la combustión de butano en un incendio es una reacción que se lleva a cabo en fracciones de segundo.
La cinética química es la parte de química física que estudia las velocidades de reacción. Los conceptos de cinética química se aplican en muchas disciplinas, tales como ingeniería química, enzimología y la ingeniería ambiental .
Definición formal de velocidad de reacción
Considere la posibilidad de una típica reacción química :
- aA + bB → PP + qQ
Las letras minúsculas (a, b, p, q) y representan coeficientes estequiométricos, mientras que las letras mayúsculas representan la reactivos (A y B) y el productos (P y Q).
De acuerdo a IUPAC de Gold Book definición la velocidad de reacción v (también R o R) para una reacción química que ocurre en una sistema cerrado en condiciones de volumen constante, y sin una acumulación de productos intermedios de reacción, se define como:
La IUPAC recomienda que la unidad de tiempo debe ser siempre la segunda. En tal caso, la velocidad de reacción difiere de la tasa de aumento de la concentración de un producto P por un factor constante (el recíproco de su número estequiométrico) y para un reactante A por menos la recíproca de la cantidad estequiométrica. La velocidad de reacción por lo general tiene las unidades de mol dm -3 s -1. Es importante tener en cuenta que la definición anterior sólo es válido para una sola reacción, en un sistema cerrado de volumen constante. Esta suposición más generalmente implícita debe indicarse explícitamente lo contrario, la definición es incorrecta: Si se añade agua a una olla que contiene agua salada, la concentración de sal disminuye, aunque no hay ninguna reacción química.
Para cualquier sistema, en general, la plena balance de materia debe tenerse en cuenta: IN - OUT + GENERACIÓN = ACUMULACIÓN
Cuando se aplica al caso simple indicado previamente esta ecuación se reduce a: ![v = \ frac {d [A]} {dt}](../../images/163/16346.png)
Para una sola reacción en un sistema cerrado de variar el volumen de la llamada tasa de conversión se puede se utiliza, con el fin de evitar la manipulación de concentraciones. Se define como la derivada de la extensión de la reacción con respecto al tiempo.

 es el coeficiente estequiométrico para i sustancia,
es el coeficiente estequiométrico para i sustancia, 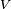 es el volumen de reacción y
es el volumen de reacción y  es la concentración de la sustancia i.
es la concentración de la sustancia i.
Cuando los productos secundarios o productos intermedios de reacción se forman, la IUPAC recomienda el uso de la tasa de los términos de la apariencia y velocidad de desaparición de los productos y reactivos, respectivamente.
Las velocidades de reacción también pueden ser definidas sobre una base que no es el volumen del reactor. Cuando un catalizador se utiliza la velocidad de reacción puede expresarse en un peso de catalizador (g mol -1 s -1) o superficie (mol m -2 s -1) base. Si la base es un sitio específico catalizador que puede ser rigurosamente contada por un método establecido, el ritmo se da en unidades de s -1 y se llama una frecuencia de rotación.
Factores que influyen en la velocidad de reacción
Los factores que afectan la velocidad de reacción:
- Concentración: aumentos de velocidad de reacción con la concentración, tal como se describe por el ley de velocidad y explicada por teoría de la colisión. Como aumenta la concentración de reactantes, la frecuencia de colisión aumenta.
- La naturaleza de la reacción: Algunas reacciones son naturalmente más rápido que otros. El número de especies que reaccionan, de su estado físico (las partículas que forman los sólidos se mueven mucho más lentamente que las de los gases o aquellos en solución ), la complejidad de la reacción y otros factores puede influir en gran medida la velocidad de una reacción.
- Temperatura : Por lo general, la realización de una reacción a una temperatura más alta proporciona más energía en el sistema y aumenta la velocidad de reacción, causando más colisiones entre las partículas, como se ha explicado por la teoría de colisión. Sin embargo, la razón principal por la que aumenta la velocidad de reacción es que más de las partículas que chocan tendrán la necesaria energía de activación que resulta en colisiones más exitosas (cuando se forman enlaces entre los reactivos). La influencia de la temperatura se describe por la Ecuación de Arrhenius. Como un regla general, las velocidades de reacción para muchas reacciones dobles o triples por cada 10 grados Celsius aumento de la temperatura, aunque el efecto de la temperatura puede ser mucho mayor o menor que este (en la medida en que las tasas de reacción puede ser independiente de la temperatura o disminuyen con aumento de la temperatura!)
Por ejemplo, el carbón se quema en una chimenea en la presencia de oxígeno pero no cuando se almacena a temperatura ambiente. La reacción es espontánea a temperaturas bajas y altas, pero a temperatura ambiente su tasa es tan lenta que es insignificante. El aumento de la temperatura, como creado por un partido, permite que la reacción para iniciar y luego se calienta en sí, ya que es exotérmica. Eso es válido para muchos otros combustibles, como el metano , butano, hidrógeno ...
- Disolvente : Muchas reacciones se llevan a cabo en solución y las propiedades del disolvente afectan a la velocidad de reacción. La fuerza iónica, así tiene un efecto sobre la velocidad de reacción.
- Presión: La velocidad de las reacciones gaseosas aumenta con la presión, que es, de hecho, equivalente a un aumento en la concentración del gas. Para las reacciones de fase condensada, la dependendence presión es débil.
- La radiación electromagnética : la radiación electromagnética es una forma de energía por lo que puede acelerar la velocidad o incluso hacer una reacción espontánea, ya que proporciona las partículas de los reactivos con más energía. Esta energía es de una forma u otra almacena en las partículas que reaccionan (puede romper los enlaces, la promoción de moléculas a los estados electrónicos o vibracionales excitados ...) la creación de especies intermedias que reaccionan fácilmente.
Por ejemplo, cuando el metano reacciona con el cloro en la oscuridad, la velocidad de reacción es muy lenta. Se puede acelerar cuando el mezcla se pone bajo luz difusa. En la luz del sol, la reacción es explosiva.
- Un catalizador : La presencia de un catalizador aumenta la velocidad de reacción (tanto en el avance y retroceso reacciones) al proporcionar una vía alternativa con una menor energía de activación .
Por ejemplo, platino cataliza la combustión de hidrógeno con oxígeno a temperatura ambiente.
- Isótopos : El efecto isotópico cinético consiste en una velocidad de reacción diferente para la misma molécula si tiene diferentes isótopos, normalmente hidrógeno isótopos, a causa de la diferencia de masa entre el hidrógeno y deuterio.
- Superficie: En reacciones en las superficies, que tienen lugar por ejemplo durante catálisis heterogénea, la velocidad de reacción aumenta a medida que el área de superficie hace. Eso es debido al hecho de que más partículas del sólido están expuestos y pueden ser afectados por las moléculas de reactivo.
- Orden: El orden de los controles de reacción cómo la concentración de reactivo afecta a la velocidad de reacción.
- La agitación: La agitación puede tener un fuerte efecto sobre la velocidad de reacción de reacciones heterogéneas.
Todos los factores que afectan a una velocidad de reacción se tienen en cuenta en la ecuación de velocidad de la reacción.
Tasa Ecuación
Para una reacción química n A + m B → C + D, la ecuación de velocidad o ley de velocidad es un expresión matemática de la cinética química para enlazar la velocidad de una reacción a la concentración de cada reactivo. Es de la clase:
En esta ecuación k (T) es el coeficiente de tasa o velocidad de reacción constante, aunque en realidad no es una constante, ya que incluye todos los parámetros que afectan a la velocidad de reacción, excepto para la concentración, que se toma en cuenta explícitamente. De todos los parámetros descritos antes, la temperatura es normalmente la más importante.
Los exponentes n  y m
y m  se llaman reacción órdenes y dependen de la mecanismo de reacción. A veces son la misma que la coeficientes estequiométricos de A y B, pero no necesariamente.
se llaman reacción órdenes y dependen de la mecanismo de reacción. A veces son la misma que la coeficientes estequiométricos de A y B, pero no necesariamente.
Estequiometría, molecularidad (el número real de moléculas que chocan) y orden de reacción sólo coincide necesariamente en reacciones elementales, es decir, aquellas reacciones que tienen lugar en un solo paso. La ecuación de reacción para reacciones elementales coincide con el proceso que tiene lugar en el nivel atómico, es decir, n moléculas del tipo A están colisionando con m moléculas de tipo B (n más m es la molecularidad).
Para los gases de la ley de velocidad también puede expresarse en unidades de presión utilizando, por ejemplo la ley de los gases ideales.
Mediante la combinación de la ley de velocidad con una balance de masa para el sistema en el que se produce la reacción, una expresión para la velocidad de cambio en la concentración se puede derivar. Para un sistema cerrado con volumen constante tal expresión puede parecer
Dependencia de la temperatura
Cada coeficiente de velocidad de reacción k tiene una dependencia de la temperatura, que generalmente se da por la Arrhenius ecuación:
E a es la energía de activación y R es el constante de los gases. Dado que en la temperatura T las moléculas tienen energías dadas por un Distribución de Boltzmann, uno puede esperar que el número de colisiones con energía superior a E a ser proporcional a  . A es el factor pre-exponencial o factor de frecuencia.
. A es el factor pre-exponencial o factor de frecuencia.
Los valores para A y E un dependen de la reacción. También hay ecuaciones más complejas posibles, que describen dependencia de la temperatura de otras constantes de velocidad que no siguen este patrón.
Dependencia de la presión
La dependencia de la presión de la constante de velocidad para condensados reacciones -Fase (es decir, cuando los reactivos y productos son sólidos o líquidos) normalmente es suffficiently débil en la gama de presiones que se encuentran normalmente en la industria que se descuida en la práctica.
La dependencia de la presión de la constante de velocidad está asociado con el volumen de activación. Para la reacción de proceder a través de un complejo de estado de activación:
el volumen de activación,  , Es:
, Es:
donde  denotar los volúmenes molares parciales de los reactivos y los productos, y
denotar los volúmenes molares parciales de los reactivos y los productos, y  indica el complejo estado de activación.
indica el complejo estado de activación.
Para la reacción anterior, uno puede esperar que el cambio de la constante de velocidad de reacción (ya sea basado en fracción molar o molal-concentración) con la presión a temperatura constante a ser:
En la práctica, el asunto puede ser complicado debido a que los volúmenes molares parciales y el volumen de activación pueden ser ellos mismos una función de la presión.
Las reacciones pueden aumentar o disminuir sus tasas con la presión, depeding en el valor de  . Como un ejemplo de la posible magnitud del efecto de presión, algunas de las reacciones orgánicas se muestran al doble de la velocidad de reacción cuando se aumentó la presión de atomospheric (0,1 MPa) a 50 MPa (que da
. Como un ejemplo de la posible magnitud del efecto de presión, algunas de las reacciones orgánicas se muestran al doble de la velocidad de reacción cuando se aumentó la presión de atomospheric (0,1 MPa) a 50 MPa (que da  = -0,025 L / mol).
= -0,025 L / mol).
Ejemplos
Para la reacción de
La ecuación de velocidad es:
La ecuación de velocidad no se limita a reflejar los reactivos coeficientes estequiométricos de la reacción global: es de primer orden en H 2, aunque el coeficiente estequiométrico es 2 y que es de segundo orden en NO.
En la cinética química generalmente se propone la reacción global que se produzca a través de un número de pasos elementales. No todas estas medidas afectan a la velocidad de reacción; normalmente es sólo el paso elemental más lento que afectan a la tasa de reación. Por ejemplo, en:
 (Equilibrio rápido)
(Equilibrio rápido)  (Lento)
(Lento)  (Rápido)
(Rápido)
Reacciones 1 y 3 son muy rápidos en comparación con el segundo, por lo que es la reacción más lenta que se refleja en la ecuación de velocidad. El paso lento se considera el paso determinante de la velocidad. Las órdenes de la ecuación de velocidad son los de la etapa determinante de la velocidad.
![v = - \ frac {1} {a} \ frac {d [A]} {dt} = - \ frac {1} {b} \ frac {d [B]} {dt} = \ frac {1} { p} \ frac {d [P]} {dt} = \ frac {1} {q} \ frac {d [Q]} {dt}](../../images/163/16344.png)

![\, R = k (T) [A] ^ {n '} [B] ^ {m'}](../../images/163/16350.png)
![\ Frac {d [C]} {dt} = k (T) [A] ^ {n '} [B] ^ {m'}](../../images/163/16352.png)





![r = k [H_2] ^ 1 [NO] ^ 2 \,](../../images/163/16362.png)
