Alotropía
Acerca de este escuelas selección Wikipedia
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk

Alotropía es propiedad de algunos elementos químicos que sea capaz de tomar dos o más formas diferentes, en los que los átomos están dispuestos de manera diferente por enlaces químicos . Las formas se conocen como alótropos de ese elemento. El fenómeno de la alotropía veces también se llama allotropism. Por ejemplo, el carbono tiene dos alótropos comunes: diamante , en donde los átomos de carbono están unidos juntos en una tetraédrica disposición de enrejado, y grafito, donde los átomos de carbono están unidos entre sí en hojas de una red hexagonal.
La palabra alotropía proviene de los griegos allos, que significa "otros", y tropos, de "manera".
Alotropía sólo se refiere a las diferentes formas de un elemento dentro de la misma fase o estado de la materia (es decir, diferentes sólidos , líquidos o gases formas). Cambios de estado (entre sólidos, líquidos y gas) no se consideran alotropía. Algunos elementos tienen alótropos que persisten en diferentes fases - por ejemplo, los dos alótropos de oxígeno ( dioxígeno, O2, y la capa de ozono , O 3), puede tanto existir en estado sólido, líquido y gaseoso. Otros elementos mantener alótropos distintos sólo en algunas fases - por ejemplo, el fósforo tiene muchas alótropos sólidos, que todo se restituya a la misma forma de P 4 cuando se funde al estado líquido.
Historia
El concepto de alotropía fue propuesta originalmente en 1841 por el científico sueco barón Jons Jakob Berzelius (1779-1848) que se ofreció ninguna explicación. Después de la aceptación de La hipótesis de Avogadro en 1860 se entendía que podían existir elementos como moléculas poliatómicas, y los dos alótropos de oxígeno fueron reconocidos como O 2 y O 3. En el siglo 20 se reconoció que otros casos, como el carbono se deben a diferencias en la estructura cristalina.
Para el año 1912, Ostwald señaló que la alotropía de elementos es sólo un caso especial del fenómeno de la polimorfismo conocido por compuestos, y propuso que los términos alótropo y alotropía ser abandonados y reemplazados por polimorfo y polimorfismo. Aunque muchos otros químicos han repetido este consejo, IUPAC y la mayoría de los textos de química todavía favorecen el uso de alótropo y alotropía sólo elementos.
Las diferencias en las propiedades de alótropos de un elemento
Alótropos son diferentes formas estructurales del mismo elemento y pueden exhibir muy diferentes propiedades físicas y comportamientos químicos. El cambio entre las formas alotrópicas se desencadena por las mismas fuerzas que afectan a otras estructuras, es decir, presión, luz, y la temperatura . Por lo tanto la estabilidad de los alótropos particulares depende de las condiciones particulares. Por ejemplo, el hierro cambia de una estructura cúbica centrada en el cuerpo (Ferrita) a un estructura cúbica centrada en las caras ( austenita) por encima de 906 ° C, y el estaño se somete a una transformación conocido como plagas estaño de un metálico de fase a un semiconductor fase debajo de 13.2 ° C.
Lista de alótropos
Por lo general, elementos capaces de variables número de coordinación y / o estados de oxidación tienden a exhibir un mayor número de formas alotrópicas. Otro factor que contribuye es la capacidad de un elemento de catenate. Alótropos suelen ser más notable en no metales y metaloides. Sin embargo, los metales tienden a tener muchos alótropos.
Ejemplos de alótropos incluyen:
Metaloides
Carbono:
- diamante - un, cristal transparente extremadamente duro, con los átomos de carbono dispuestos en una red tetraédrica. Un conductor eléctrico pobre. Un excelente conductor térmico.
- grafito - una suave, negro, sólido escamoso, un conductor eléctrico moderado. Los átomos de carbono están unidos en celosías hexagonales planas, las cuales son en capas en hojas.
- carbono amorfo
- fullerenos, incluyendo " buckyballs ", tales como C 60, y los nanotubos de carbono
Fósforo:
- El fósforo blanco - P sólido cristalino 4
- Red fósforo - sólido polimérico
- Fósforo Scarlet
- Fósforo violeta
- Negro de fósforo - semiconductor, análoga a la de grafito
- Difósforo
Oxígeno:
- dioxígeno, O2 - incoloro
- ozono , O 3 - azul
- Tetraoxygen, O 4 - metaestable
- octaoxygen, O 8 - rojo
- dinitrógeno
- tetranitrogen
- trinitrogen
- dos formas sólidas: una hexagonal embalado y el otro alfa cúbico
Azufre:
- Plástico (amorfo) de azufre - sólido polimérico
- Azufre rómbico - grandes cristales compuestos de S 8 moléculas
- Azufre monoclínico - cristales aciculares finos
- Otras moléculas de anillo tales como S 7 y S 12
Selenio :
- "Selenio Roja", la ciclo-Se 8
- Selenio Gray, Se polimérico
- Selenio Negro
Los metaloides
- boro amorfo - polvo de color marrón
- boro cristalino - negro, duro (9,3 en la escala de Mohs), y un conductor débil a temperatura ambiente.
- silicio amorfo - polvo de color marrón
- silicio nanocristalino - similar a la del silicio amorfo
- silicio cristalino - tiene un brillo metálico y un color grisáceo. Los monocristales de silicio cristalino se pueden cultivar con un proceso conocido como el proceso de Czochralski
Arsénico :
- Arsénico amarillo - molecular no metálico Como 4
- Arsénico Gray, Como polimérico (metaloide)
- Arsénico negro (metaloide) y varios otros similares.
- azul-blanco de antimonio - la forma estable (metaloide)
- antimonio amarillo (no metálico)
- negro de antimonio (no metálico)
- (Un cuarto demasiado)
El polonio tiene dos alótropos metálicos.
Metales
- estaño gris (alfa-estaño)
- estaño blanco (estaño beta)
- estaño romboidal (gamma)
Hierro
- ferrita (hierro alfa) - formas siguientes 770 ° C (el punto de Curie, Tc); el hierro se vuelve magnético en su forma alfa; BCC
- beta - formas siguientes 912 ° C (BCC)
- gamma - siguientes formularios 1401 ° C; cara cúbica centrada (FCC) estructura cristalina
- delta - formas de enfriamiento de hierro fundido por debajo de 1.535 ° C; tiene una cúbico (BCC) estructura cristalina centrada en el cuerpo
El titanio tiene dos alótropos
El estroncio tiene tres alótropos
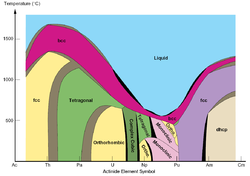
Lantanides y actínidos
- El plutonio tiene seis alótropos sólidos distintos bajo presiones "normales". Sus densidades varían dentro de una relación de alrededor del 4: 3, lo que complica enormemente todo tipo de trabajos con el metal (en particular fundición, mecanizado y almacenamiento). Existe una séptima alótropo plutonio a presiones muy altas, lo que añade más dificultades en aplicaciones exóticas.
- Iterbio tiene tres alótropos
- Terbio tiene dos alótropos cristalinos
- Prometio tiene dos formas alotrópicas
- Curium tiene 3 alótropos (también americio , berkelio , californio hacer)