
Nitrógeno
Antecedentes de las escuelas de Wikipedia
Organizar una selección Wikipedia para las escuelas en el mundo en desarrollo sin acceso a Internet era una iniciativa de SOS Children. Una buena manera de ayudar a otros niños es mediante el patrocinio de un niño
| Nitrógeno | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
7 N | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||
gas incoloro, líquido o sólido  Nitrógeno líquido Las líneas espectrales de nitrógeno | |||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||
| Nombre, símbolo, número | nitrógeno, N, 7 | ||||||||||||||||||||||||
| Pronunciación | / n aɪ t r ə dʒ ə n / NY -trə-jən | ||||||||||||||||||||||||
| Categoría Elemento | no metal | ||||||||||||||||||||||||
| Grupo, período, bloque | 15 (pnictogens), 2, p | ||||||||||||||||||||||||
| Peso atómico estándar | 14.007 (1) | ||||||||||||||||||||||||
| Configuración electrónica | [Él] 2s 2 2p 3 2, 5 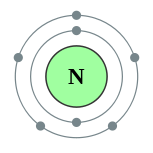 | ||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||
| Descubrimiento | Daniel Rutherford (1772) | ||||||||||||||||||||||||
| Nombrado por | Jean-Antoine Chaptal (1790) | ||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||
| Fase | gas | ||||||||||||||||||||||||
| Densidad | (0 ° C, 101,325 kPa) 1,251 g / L | ||||||||||||||||||||||||
| Líquido densidad en pb | 0,808 g · cm -3 | ||||||||||||||||||||||||
| Punto de fusion | 63.15 K , -210.00 ° C, -346.00 ° F | ||||||||||||||||||||||||
| Punto de ebullicion | 77.36 K, -195.79 ° C, -320.33 ° F | ||||||||||||||||||||||||
| Punto Triple | 63,1526 K (-210 ° C), 12,53 kPa | ||||||||||||||||||||||||
| Punto crítico | 126,19 K, 3,3978 MPa | ||||||||||||||||||||||||
| Calor de fusión | (2 N) 0,72 kJ · mol -1 | ||||||||||||||||||||||||
| El calor de vaporización | (N 2) 5,56 kJ · mol -1 | ||||||||||||||||||||||||
| Capacidad calorífica molar | (N 2) 29.124 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||
| Estados de oxidación | 5, 4, 3, 2, 1, -1, -2, -3 (Fuertemente ácida óxido) | ||||||||||||||||||||||||
| Electronegatividad | 3,04 (escala de Pauling) | ||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 1402,3 kJ · mol -1 | ||||||||||||||||||||||||
| Segundo: 2856 kJ · mol -1 | |||||||||||||||||||||||||
| Tercero: 4578,1 kJ · mol -1 | |||||||||||||||||||||||||
| Radio covalente | 71 ± 13:00 | ||||||||||||||||||||||||
| Van der Waals radio | 155 pm | ||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||
| Estructura cristalina | hexagonal  | ||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||
| Conductividad térmica | 25,83 × 10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||
| Velocidad del sonido | (Gas, 27 ° C) 353 m · s -1 | ||||||||||||||||||||||||
| Número de registro del CAS | 7727-37-9 | ||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||
| Artículo principal: Los isótopos de nitrógeno | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El nitrógeno es un elemento químico con el símbolo N y número atómico 7. Nitrógeno elemental es un gas incoloro, inodoro, insípido, y en su mayoría inerte gas diatómico en condiciones estándar, que constituyen 78,09% en volumen de la atmósfera de la Tierra . El elemento nitrógeno fue descubierto como un componente separable del aire, por el médico escocés Daniel Rutherford, en 1772. Pertenece a la familia Grupo del nitrógeno.
El nitrógeno es un elemento común en el universo, estimada en alrededor de séptimo en la abundancia total en nuestra galaxia y el Sistema Solar . Es sintetizada por fusión de carbono y de hidrógeno en supernovas . Debido a la volatilidad de nitrógeno elemental y sus compuestos comunes con el hidrógeno y el oxígeno, el nitrógeno es mucho menos común en los planetas rocosos del Sistema Solar interior, y es un elemento relativamente raro en la Tierra en su conjunto. Sin embargo, como en la Tierra, el nitrógeno y sus compuestos se producen comúnmente en forma de gases en la atmósfera de planetas y lunas que tienen atmósferas.
Muchos compuestos industrialmente importantes, tales como amoníaco , ácido nítrico , nitratos orgánicos ( propelentes y explosivos), y cianuros, contener nitrógeno. El extremadamente fuerte unión en nitrógeno elemental domina la química de nitrógeno, causando dificultad para ambos organismos y la industria en la conversión (o "fijación"), el N 2 en útiles compuestos , pero al mismo tiempo, causando liberación de grandes cantidades de energía a menudo útil cuando los compuestos quemar, explotar, o decaer en gas nitrógeno. Producido sintéticamente amoniaco y nitratos son industriales clave fertilizantes y nitratos de los fertilizantes son la clave contaminantes en la causa de la eutrofización de los sistemas de agua.
Fuera de sus usos principales como fertilizantes y energía-tiendas, compuestos nitrogenados orgánicos son versátiles. El nitrógeno es parte de materiales tan diversos como el Kevlar tejido y cianoacrilato pegamento "super". El nitrógeno es un constituyente de moléculas en cada clase importante de drogas farmacológica, incluyendo los antibióticos . Muchos fármacos son imita o profármacos de las moléculas de señal que contienen nitrógeno naturales: por ejemplo, los nitratos orgánicos nitroglicerina y nitroprusiato de control de la presión arterial por ser metabolizados a los desastres naturales óxido nítrico. Planta alcaloides (a menudo los productos químicos de defensa) contienen nitrógeno, por definición, y por lo tanto muchos de los medicamentos que contienen nitrógeno notables, como la cafeína y la morfina son o alcaloides o sus imitaciones sintéticas que actúan (como muchos alcaloides de la planta hacen) sobre los receptores de los animales neurotransmisores (por ejemplo, sintética anfetaminas).
El nitrógeno se produce en todos los organismos, principalmente en aminoácidos (y por tanto proteínas ) y también en el ácidos nucleicos ( ADN y RNA). El cuerpo humano contiene aproximadamente 3% en peso de nitrógeno, el cuarto elemento más abundante en el cuerpo después del oxígeno, carbono, e hidrógeno. El ciclo del nitrógeno describe el movimiento del elemento del aire en los biosfera compuestos orgánicos y, a continuación, de nuevo en la atmósfera.
Historia y etimología
El nitrógeno se considera formalmente haber sido descubierto por el médico escocés Daniel Rutherford en 1772, quien lo llamó aire nocivo o aire fijo. El hecho de que no era constitutiva de aire que no es compatible combustión estaba claro para Rutherford. El nitrógeno también se estudió a aproximadamente el mismo tiempo por Carl Wilhelm Scheele, Henry Cavendish, y Joseph Priestley, quien se refirió a él como el aire quemado o aire flogisticado. El gas nitrógeno era lo suficientemente inerte que Antoine Lavoisier se refirió a ella como " aire pestilente "o azote, de la palabra griega ἄζωτος (azotos) que significa" sin vida ". En ella, los animales murieron y las llamas fueron extinguidas. El nombre de Lavoisier para el nitrógeno se utiliza en muchos idiomas (francés, italiano, polaco, ruso, albanés, etc. .) y todavía permanece en Inglés en los nombres comunes de muchos compuestos, tales como hidrazina y compuestos de la ion azida.
El Inglés palabra de nitrógeno (1794) entró en el idioma de la nitrogène francés, acuñado en 1790 por el químico francés Jean-Antoine Chaptal (1756-1832), de la "nitron" griego ( carbonato de sodio) y el gen francés (producir). El gas se había encontrado en el ácido nítrico . Significado de Chaptal era que el gas nitrógeno es la parte esencial de ácido nítrico, a su vez formado a partir de salitre ( nitrato de potasio ), entonces conocido como nitro. Esta palabra en el mundo más antiguo originalmente descrita sodio sales que no contenían nitrato, y es un cognado de natrón.
Los compuestos de nitrógeno eran bien conocidos por la Edad Media. alquimistas sabían ácido nítrico como agua fuerte (agua fuerte). La mezcla de ácido nítrico y ácido clorhídrico era conocido como agua regia (agua real), célebre por su capacidad de disolver el oro (el rey de los metales). El primer militar, y aplicaciones agrícolas industriales de compuestos nitrogenados utilizados salitre ( nitrato de sodio o nitrato de potasio), más notablemente en la pólvora , y más tarde como fertilizante . En 1910, Lord Rayleigh descubrió que una descarga eléctrica en gas nitrógeno producido "nitrógeno activo", un alótropo considerado monoatómico. La "nube de luz que gira amarillo brillante", producido por su aparato reacciona con el mercurio para producir explosivos nitruro de mercurio.
Producción
El nitrógeno es un gas gas industrial producido por la fraccional de destilación de líquido de aire , o por medios mecánicos utilizando aire gaseoso (es decir, inversa a presión membrana de ósmosis o Presión oscilación de adsorción). Nitrógeno comercial es a menudo un subproducto de procesamiento de aire para la concentración industrial de oxígeno para la fabricación de acero y otros fines. Cuando se suministra comprimido en cilindros a menudo se llama OFN (nitrógeno libre de oxígeno).
En un laboratorio químico que se prepara tratando una solución acuosa de con cloruro de amonio nitrito de sodio.
- NH 4 Cl (aq) + NaNO2 (aq) → N 2 (g) + NaCl (aq) + 2 H 2 O (l)
Pequeñas cantidades de impurezas NO y HNO 3 también se forman en esta reacción. Las impurezas se pueden eliminar haciendo pasar el gas a través de ácido sulfúrico acuosa que contiene dicromato de potasio. Muy nitrógeno puro se puede preparar por la descomposición térmica de azida de bario o azida de sodio.
- 2 NaN 3 → 2 Na + 3 N 2
Propiedades
El nitrógeno es un no metal, con un electronegatividad de 3.04. Cuenta con cinco electrones en su shell exterior y es, por lo tanto, trivalente en la mayoría de los compuestos. La triple enlace en nitrógeno molecular (N 2) es uno de los más fuertes. La dificultad que resulta de la conversión de N 2 en otros compuestos, y la facilidad (y la liberación de alta energía asociada) de la conversión de compuestos de nitrógeno en N elemental 2, han dominado el papel de nitrógeno en la naturaleza y las actividades económicas humanas.
En presión atmosférica de nitrógeno molecular condensa ( licua ) en 77 K (-195,79 ° C ) y se congela a 63 K (-210,01 ° C) en la beta hexagonal compacta cristal alotrópica formulario. Por debajo de 35.4 K (-237,6 ° C) de nitrógeno asume la forma alotrópica cristal cúbico (llamada la fase alfa). El nitrógeno líquido, un agua que se asemeja líquido en apariencia, pero con el 80,8% de la densidad (la densidad del nitrógeno líquido en su punto de ebullición es 0,808 g / ml), es un común criogénico.
Alótropos inestable de nitrógeno que consiste en más de dos átomos de nitrógeno se han producido en el laboratorio, como N 3 y N 4. Bajo presiones extremadamente altas (1,1 millones atm) y las altas temperaturas (2000 K), tal como se produce utilizando una celda de yunque de diamante, el nitrógeno se polimeriza en la estructura cristalina cúbica gauche un solo régimen de servidumbre. Esta estructura es similar a la de diamante , y ambos tienen extremadamente fuerte enlaces covalentes. N 4 se apoda "diamante de nitrógeno".
Otros alótropos (aún unsynthesized) incluyen Hexazina (6 N, un benceno analógica) y octaazacubane (N 8, un analógico cubane). El primero se prevé que sea muy inestable, mientras que el segundo se prevé que sea cinéticamente estable, por razones de simetría orbital.
Isótopos
Hay dos estables isótopos de nitrógeno: 14 N y 15 N. Con mucho, el más común es 14 N (99,634%), que se produce en el Ciclo CNO en estrellas . De los diez isótopos producidos sintéticamente, 13 N tiene una vida media de diez minutos y los isótopos restantes tienen vidas medias del orden de segundos o menos.
Biológicamente mediada por reacciones (por ejemplo, asimilación, nitrificación , y desnitrificación) controlar fuertemente la dinámica del nitrógeno en el suelo. Estas reacciones dan lugar típicamente a 15 N enriquecimiento de la sustrato y el agotamiento de la producto.
Una pequeña parte (0,73%) del nitrógeno molecular en la atmósfera de la Tierra es el Isotopólogo 14 N 15 N, y casi todo el resto es 14 N 2.
El radioisótopo 16 N es el radionúclido dominante en el refrigerante de reactores de agua a presión o reactores de agua hirviendo durante el funcionamiento normal. Se produce a partir de 16 oh (en agua) a través de (N, p) de reacción. Tiene una corta vida media de aproximadamente 7,1 s, pero durante su decadencia de nuevo a 16 O produce de alta energía la radiación gamma (de 5 a 7 MeV).
Debido a esto, el acceso a la tubería de refrigerante primario en un reactor de agua a presión debe ser restringido durante el funcionamiento de potencia del reactor. 16 N es uno de los principales medios utilizados para detectar inmediatamente incluso pequeñas fugas del refrigerante primario al ciclo de vapor secundario.
De manera similar, el acceso a cualquiera de los componentes del ciclo de vapor en una planta de energía nuclear reactor de agua en ebullición debe ser restringido durante el funcionamiento. El condensado procedente del condensador es normalmente retenido durante 10 minutos para permitir la descomposición de la 16 N. Esto elimina la necesidad de proteger y restringir el acceso a cualquiera de la tubería de agua de alimentación o bombas.
Espectro electromagnético

El nitrógeno molecular (N 2 14) es en gran parte transparente para infrarrojos y radiación visible porque es una homonuclear molécula y, por lo tanto, no tiene momento dipolar para acoplarse a la radiación electromagnética en estos longitudes de onda. Significativo la absorción se produce a extremos ultravioletas longitudes de onda, comenzando alrededor de 100 nanómetros. Esto se asocia con transiciones electrónicas en la molécula a los estados en los que la carga no se distribuye de manera uniforme entre los átomos de nitrógeno. Absorción de nitrógeno conduce a una absorción significativa de la radiación ultravioleta en la atmósfera superior de la Tierra y las atmósferas de otros cuerpos planetarios. Por razones similares, puro molecular láseres de nitrógeno típicamente emiten luz en el rango ultravioleta.
El nitrógeno también hace una contribución a visible aire resplandor de la atmósfera superior de la Tierra, a través de la excitación por impacto electrónico seguido de emisión. Este resplandor visible aire azul (visto en el polo aurora y en el resplandor re-entrada de volver nave espacial) normalmente no se traduce a partir de nitrógeno molecular sino de átomos de nitrógeno libres que combinan con el oxígeno para formar óxido nítrico (NO).
Gas nitrógeno también exhibe de centelleo.
Reacciones

En general, el nitrógeno es no reactivo a temperatura y presión estándar. N 2 reacciona espontáneamente con pocas reactivos, siendo resistente a los ácidos y bases, así como oxidantes y reductores mayoría. Cuando el nitrógeno reacciona espontáneamente con un reactivo, la transformación neta a menudo se llama fijación de nitrógeno .
El nitrógeno elemental reacciona con el litio . El litio se quema en una atmósfera de N 2 para dar nitruro de litio:
- 6 Li + N 2 → 2 Li 3 N
El magnesio también se quema en nitrógeno, formando nitruro de magnesio.
- 3 Mg + N 2 → Mg 3 N 2
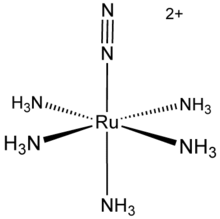
N 2 forma una variedad de aductos con metales de transición. El primer ejemplo de una complejo de dinitrógeno es [Ru (NH 3) 5 (N 2)] 2+ (ver figura de la derecha). Sin embargo, es interesante observar que el ligando N2 se obtuvo por la descomposición de hidrazina, y no coordinación de dinitrógeno libre. Tales compuestos son ahora numerosos, otros ejemplos incluyen IrCl (N 2) (PPh3) 2, W (N 2) 2 ( Ph 2 PCH 2 CH 2 PPh 2) 2, y [(η 5 -C 5 Me 4 H) Zr 2] 2 ( 2 μ, η 2, η 2 -N 2). Estos complejos de N 2 ilustran cómo podría obligar al metal (s) en nitrogenasa y el catalizador para la Proceso de Haber. Un proceso catalítico para reducir N 2 a amoníaco con el uso de un molibdeno complejo en presencia de una fuente de protones se publicó en 2005.
El punto de partida para la producción industrial de compuestos de nitrógeno es el Proceso de Haber, en el que el nitrógeno se fija mediante la reacción de N 2 y H 2 sobre una plancha (II, III) óxido (Fe 3 O 4) de catalizador a aproximadamente 500 ° C y 200 atmósferas de presión. Fijación biológica del nitrógeno en vida libre cianobacterias y en el nódulos de las raíces de las plantas también produce amoníaco del nitrógeno molecular. La reacción, que es la fuente de la mayor parte de nitrógeno en la biosfera , es catalizada por la nitrogenasa complejo enzimático que contiene átomos de Fe y Mo, utilizando la energía derivada de la hidrólisis del trifosfato de adenosina (ATP) en difosfato de adenosina y inorgánico fosfato (-20,5 kJ / mol).
Aparición
El nitrógeno es el componente más grande de la Tierra 's atmósfera (78,082% en volumen de aire seco, 75,3% en peso en aire seco). Sin embargo, esta alta concentración no refleja baja abundancia global de nitrógeno en la composición de la Tierra, de la cual la mayor parte del elemento escaparon por evaporación solar, temprano en la formación del planeta.
El nitrógeno es un elemento común en el universo, y se estima en aproximadamente séptimo más abundante elemento químico de la masa en el universo, nuestra galaxia y el Sistema Solar. Su aparición no se cree que es del todo debido a la síntesis por la fusión de carbono e hidrógeno en supernovas. En estos lugares se creó originalmente por procesos de fusión de carbono e hidrógeno en supernovas . Molecular de nitrógeno y nitrógeno compuestos han sido detectados en espacio interestelar por los astrónomos utilizando el Lejos Explorador espectroscópico ultravioleta.
Debido a la volatilidad de nitrógeno elemental y sus compuestos comunes con hidrógeno y oxígeno, nitrógeno y sus compuestos fueron expulsados de la planetesimales en el Sistema Solar temprano por el calor del Sol, y en forma de gases, se perdieron a los planetas rocosos del Sistema Solar interior. Por lo tanto, el nitrógeno es un elemento relativamente raro en estos planetas interiores, incluida la Tierra, como un todo. En este, el nitrógeno se asemeja neón, que tiene una abundancia similar en el universo, pero también es poco frecuente en el Sistema Solar interior. El nitrógeno se estima en 30 º de los elementos en la abundancia de la corteza terrestre. Existen algunos minerales de nitrógeno relativamente poco frecuentes, como el salitre (nitrato de potasio), Chile salitre (nitrato de sodio) y sal amoniaco (cloruro de amonio). Incluso estos son conocidos principalmente como concentrado a partir de lechos marinos de evaporación, debido a su fácil solubilidad de la mayoría de origen natural compuestos de nitrógeno en el agua. Un patrón similar se produce con la solubilidad en agua de la luz raro elemento boro .
Sin embargo, el nitrógeno y sus compuestos se producen mucho más comúnmente en forma de gases en la atmósfera de planetas y lunas que son lo suficientemente grandes como para tener atmósferas. Por ejemplo, el nitrógeno molecular es un componente importante de no sólo la atmósfera de la Tierra, sino también la de Saturno luna La espesa atmósfera de Titán. Asimismo, debido a la retensión por gravedad a temperaturas más frías, nitrógeno y sus compuestos se producen en apreciable a trazas en las atmósferas planetarias de los planetas gigantes de gas.
El nitrógeno está presente en todos los organismos vivos y, en proteínas, ácidos nucleicos y otras moléculas. Es típicamente constituye alrededor del 4% del peso seco de la materia de la planta, y alrededor de 3% del peso del cuerpo humano. Es un gran componente de los residuos animales (por ejemplo, guano), generalmente en forma de urea , acido urico, compuestos de amonio, y derivados de estos productos nitrogenados, que son esenciales nutrientes para todas las plantas que no pueden fijar el nitrógeno atmosférico .
Compuestos
La principal neutral hidruro de nitrógeno es amoníaco (N H 3), aunque hidrazina (N 2 H 4) también se utiliza comúnmente. El amoníaco es más básica de agua por 6 órdenes de magnitud. En la solución de amoniaco se forma la de amonio de iones (NH +
4). El amoníaco líquido (punto de ebullición 240 K) es amphiprotic (que muestra ya sea Brønsted-Lowry carácter ácido o básico) y forma de amonio y el menos común iones amida (NH -
2); tanto amidas y nitruro de (3- N) sales son conocidas, pero descomponerse en agua. Individualmente, los compuestos de alquilo doblemente, triplemente y cuádruplemente sustituidos de amoniaco se denominan aminas (cuatro sustituciones, para formar comercialmente y biológicamente importantes aminas cuaternarias, los resultados en un nitrógeno cargado positivamente, y por lo tanto una soluble en agua, o al menos anfifílico, compuesto). Grandes cadenas, anillos y estructuras de hidruros de nitrógeno también son conocidos, pero son generalmente inestables.
Otras clases de nitrógeno aniones (iones con carga negativa) son venenosas azidas (N -
3), que son lineales y isoelectrónico de dióxido de carbono , pero que se unen a las enzimas que contienen hierro importantes en el cuerpo de una manera más parecido cianuro. Otra molécula de la misma estructura es el gas anestésico incoloro y relativamente inerte El óxido nitroso (monóxido de dinitrógeno, N 2 O), también conocido como gas de la risa. Este es uno de una variedad de nitrógeno óxidos que forman una familia a menudo abreviado como NOx. Óxido nítrico ( monóxido de nitrógeno, NO), es un producto natural usado radicales libres en transducción de señales en las plantas y los animales, por ejemplo, en vasodilatación haciendo que el músculo liso de los vasos sanguíneos se relajen. El rojizo y venenoso dióxido de nitrógeno NO2 contiene un unpaired de electrones y es un componente importante de la niebla con humo . Moléculas de nitrógeno que contienen electrones desapareados muestran una tendencia a dimerizar (emparejamiento por lo tanto los electrones), y son, en general, altamente reactivo. Los ácidos correspondientes son HNO 2 nitroso y ácido nítrico HNO 3, con las correspondientes sales llamados nitritos y nitratos .}
Los óxidos superiores dinitrógeno trióxido de N 2 O 3, dinitrógeno tetróxido de N 2 O 4 y dinitrógeno pentóxido de N 2 O 5, son inestables y explosivo, una consecuencia de la estabilidad química de N 2. Casi todos los motor de cohete hipergólico utiliza N 2 O 4 como oxidante; sus combustibles, diversas formas de hidrazina, también son compuestos de nitrógeno. Estos motores se utilizan ampliamente en las naves espaciales tales como el transbordador espacial y las de la Programa Apollo porque sus propulsores son líquidos a temperatura ambiente y se produce la ignición en contacto sin un sistema de encendido, permitiendo que muchos quemaduras controladas con precisión. Algunos vehículos de lanzamiento, como el Titan II y Ariane 1 a 4 también utilizan combustibles hipergólicos, aunque la tendencia está fuera de estos motores por razones de coste y de seguridad. N 2 O 4 es un intermedio en la fabricación de ácido nítrico HNO 3, uno de los pocos ácidos más fuertes que hidronio y un bastante fuerte agente oxidante.
El nitrógeno es notable por la variedad de compuestos inestables explosiva que puede producir. Triyoduro de nitrógeno NI 3 es un extremadamente sensible en contacto con explosivo. Nitrocelulosa, producida por nitración de la celulosa con ácido nítrico, también se conoce como pólvora de algodón. La nitroglicerina, hecho por nitración de glicerina, es el ingrediente explosivo peligrosamente inestable de dinamita. El explosivo relativamente estable, pero menos potente trinitrotolueno (TNT) es el explosivo norma con la que se mide la potencia de las explosiones nucleares.
El nitrógeno también se puede encontrar en compuestos orgánicos . Nitrógeno Común grupos funcionales incluyen: aminas , amidas, grupos nitro, iminas, y enaminas. La cantidad de nitrógeno en una sustancia química se puede determinar por el Método de Kjeldahl.
Aplicaciones

El gas nitrógeno
El gas nitrógeno tiene una variedad de aplicaciones, incluyendo el servicio como un sustitución inerte para aire donde la oxidación no es deseable;
- Como un atmósfera modificada, puro o mezclado con dióxido de carbono , para preservar la frescura de los alimentos envasados oa granel (retrasando rancidez y otras formas de daño oxidativo) de nitrógeno puro como aditivo alimentario está etiquetado en la Unión Eurpean con la E número E941 .
- En ordinaria bombillas incandescentes como una alternativa de bajo costo para el argón .
- La producción de partes electrónicas tales como transistores, diodos y circuitos integrados .
- Secos y presurizado, como una dieléctrico gas para equipos de alta tensión.
- La fabricación de acero inoxidable.
- Se utiliza en los sistemas de combustible de aviones militares para reducir el riesgo de incendio, (véase sistema de inertización).
- Encima de explosivos líquidos como medida de seguridad.
- Llenado de automoción y aeronaves neumáticos debido a su inercia y la falta de humedad o cualidades oxidativos, en lugar de aire. La diferencia en el contenido de N 2 entre el aire y N pura 2 es 20%.
- Utilizado como propulsor para proyecto de vino , y como una alternativa a o junto con dióxido de carbono para otras bebidas.
El nitrógeno se utiliza comúnmente durante los procedimientos de preparación de muestras para el análisis químico. Se utiliza para concentrar y reducir el volumen de muestras líquidas. Dirigir una corriente de gas nitrógeno a presión perpendicular a la superficie del líquido permite que el disolvente se evapore dejando el soluto (s) y no-disolvente evaporado atrás.
Tanques de nitrógeno también están reemplazando dióxido de carbono como la fuente de energía principal para la pistolas de paintball. El nitrógeno debe mantenerse a una presión más alta que el CO 2, por lo que N 2 tanques pesados y más caros.
El nitrógeno puede ser utilizado como un reemplazo, o en combinación con, el dióxido de carbono para presurizar barriles de algunas cervezas , en particular stouts y británicos cervezas, debido a la menor burbujas que produce, lo que hace que la cerveza dispensada más suave y más embriagadora. Una cápsula de nitrógeno sensible a la presión conocido comúnmente como " Obtener el widget "permite cervezas cargados de nitrógeno a envasar en latas y botellas.
Nitrógeno líquido
El nitrógeno líquido es una líquido criogénico. A presión atmosférica, hierve a -195,8 ° C. Cuando aislada en recipientes adecuados tales como Frascos Dewar, que pueden ser transportados sin mucho la pérdida por evaporación.
Al igual que el hielo seco , el principal uso de nitrógeno líquido es como refrigerante. Entre otras cosas, se utiliza en el criopreservación de la sangre, las células reproductivas ( esperma y huevo), y otras muestras biológicas y materiales. Se utiliza en el ámbito clínico en crioterapia para eliminar quistes y verrugas en la piel. Se utiliza en trampas frías para ciertos equipos de laboratorio y enfriar detectores de infrarrojos o Detectores de rayos X. También se ha utilizado para enfriar las unidades de procesamiento centrales y otros dispositivos en los equipos que están overclockeado, y que producen más calor que durante el funcionamiento normal.
Los compuestos de nitrógeno
El nitrógeno molecular (N 2) en la atmósfera es relativamente no reactivo debido a su fuerte vínculo, y N 2 juega un papel inerte en el cuerpo humano, no ser ni producido ni se destruye. En la naturaleza, el nitrógeno se convierte en biológicamente (e industrialmente) compuestos útiles por un rayo, y por algunos organismos vivos, en particular ciertas bacterias (es decir, fijación de nitrógeno bacterias ver Papel biológico abajo). El nitrógeno molecular se libera a la atmósfera en el proceso de decaimiento, en tejidos de plantas y animales muertos.
La capacidad de combinar, o fijar, nitrógeno molecular es una característica clave de la química industrial moderna, donde el nitrógeno y el gas natural se convierten en amoniaco a través de la Proceso de Haber. El amoníaco, a su vez, se puede utilizar directamente (principalmente como un fertilizante , y en la síntesis de fertilizantes nitrados), o como un precursor de muchos otros materiales incluyendo importantes explosivos, en gran medida a través de la producción de ácido nítrico por el Proceso de Ostwald.
Los orgánicos e inorgánicos sales del ácido nítrico han sido importantes históricamente como tiendas de conveniencia de la energía química. Ellos incluyen compuestos importantes tales como nitrato de potasio (utilizado en la pólvora ) y nitrato de amonio, un fertilizante importante y explosivo (véase ANFO). Varios otros compuestos orgánicos nitrados, tales como nitroglicerina, trinitrotolueno, y nitrocelulosa, se utilizan como explosivos y propelentes para armas de fuego modernas. El ácido nítrico se utiliza como agente oxidante en combustible líquido cohetes. Derivados de hidracina y la hidracina encuentran uso como cohete combustibles y monopropelentes. En la mayoría de estos compuestos, la inestabilidad básica y tendencia a quemarse o explotar se deriva del hecho de que el nitrógeno está presente como un óxido, y no como la molécula de nitrógeno mucho más estable (N 2), que es un producto de los compuestos ' la descomposición térmica. Cuando nitratos queman o explotan, la formación de la poderosa triple enlace en la N 2 produce la mayor parte de la energía de la reacción.
El nitrógeno es un constituyente de moléculas en cada clase importante de drogas en la farmacología y la medicina. El óxido nitroso (N 2 O) fue descubierto a principios del siglo 19 al ser un anestésico parcial, a pesar de que no se utilizó como un anestésico quirúrgico hasta más tarde. Llamado " gas de la risa ", se encontró capaz de inducir un estado de desinhibición social de embriaguez parecido. Otros fármacos que contienen nitrógeno notables son drogas derivadas de plantas alcaloides, como la morfina (no existen muchos alcaloides se sabe que tienen efectos farmacológicos; en algunos casos, aparecen como defensas químicas naturales de las plantas contra la depredación). Los medicamentos que contienen nitrógeno incluyen todas las principales clases de antibióticos y medicamentos de nitrato orgánicos como nitroglicerina y nitroprusiato que regular la presión arterial y la acción del corazón mediante la imitación de la acción de óxido nítrico.
Papel biológico
El nitrógeno es un elemento esencial de la construcción de amino y ácidos nucleicos, esencial para la vida en la Tierra.
Nitrógeno elemental en la atmósfera no puede ser utilizada directamente por plantas o animales, y debe ser convertida a una (o "fijo") estado reducido para ser útil para las plantas y animales superiores. Precipitación a menudo contiene cantidades sustanciales de amonio y nitrato , que se cree son el resultado de la fijación de nitrógeno por rayo y otros fenómenos eléctricos atmosféricos. Esto fue propuesto por primera vez por Liebig en 1827 y más tarde confirmado. Sin embargo, debido de amonio se retiene preferentemente por el bosque de dosel en relación con nitrato atmosférico, más nitrógeno fijo alcanza el suelo superficial debajo de árboles como el nitrato. Nitrato del suelo se asimila preferentemente por árbol raíces relativos a amonio suelo.
Específicas bacterias (por ejemplo, Trifolium Rhizobium) poseer nitrogenasa enzimas que pueden fijar el nitrógeno atmosférico (ver la fijación de nitrógeno ) en una forma ( ion amonio) que es químicamente útil para los organismos superiores. Este proceso requiere una gran cantidad de energía y condiciones anóxicas. Estas bacterias pueden vivir libremente en el suelo (por ejemplo, Azotobacter) pero normalmente existen en una relación simbiótica en la nódulos de las raíces de las leguminosas (por ejemplo, trébol, Trifolium, o soja planta, Glycine max ). Bacterias fijadoras de nitrógeno son también simbiótica con un número de especies de plantas no relacionadas tales como alisos ( Alnus) spp., Líquenes, Casuarina, Myrica, hepáticas, y Gunnera.
Como parte de la relación simbiótica, la planta convierte el ion amonio "fijo" a los óxidos de nitrógeno y aminoácidos para formar proteínas y otras moléculas, (por ejemplo, alcaloides). A cambio del nitrógeno "fijo", la planta segrega azúcares a las bacterias simbióticas. Legumbres mantienen una anaeróbico (sin oxígeno) medio ambiente por sus bacterias fijadoras de nitrógeno.
Las plantas son capaces de asimilar directamente de nitrógeno en forma de nitratos que pueden estar presentes en el suelo de depósitos naturales minerales, fertilizantes artificiales, residuos animales, o la descomposición orgánica (como el producto de las bacterias, pero no las bacterias específicamente asociados con la planta). Los nitratos absorbidas de este modo se convierten en nitritos por la enzima nitrato reductasa, y luego se convierte en amoníaco por otra enzima llamada nitrito reductasa.
Los compuestos de nitrógeno son bloques de construcción básicos de la biología animal. Los animales usan contienen nitrógeno aminoácidos de origen vegetal como materiales de partida para todos los animales bioquímica-nitrógeno compuesto, incluyendo la fabricación de proteínas y ácidos nucleicos. Los insectos que se alimentan de plantas dependen de nitrógeno en su dieta, de manera que la variación de la cantidad de fertilizante de nitrógeno aplicado a una planta puede afectar la tasa de reproducción de los insectos que se alimentan de plantas fertilizadas.
Nitrato soluble es un importante factor limitante en el crecimiento de ciertas bacterias en aguas oceánicas. En muchos lugares del mundo, artificiales fertilizantes aplicados a cultivos y tierras para aumentar los rendimientos resultan en la entrega de escorrentía de nitrógeno soluble a los océanos en las desembocaduras de los ríos. Este proceso puede dar lugar a la eutrofización del agua, como el crecimiento bacteriano nitrógeno impulsada agota el oxígeno del agua hasta el punto de que todos los organismos superiores mueren. Bien conocido áreas "zona muerta" en los EE.UU. Costa del Golfo y el Mar Negro se deben a este importante proceso de contaminación.
Muchos peces de agua salada fabricar grandes cantidades de óxido de trimetilamina para protegerlos de la alta efectos osmóticos de su entorno; la conversión de este compuesto a dimetilamina es responsable del olor a principios de peces de agua salada filetes. En los animales, radicales libres óxido nítrico (NO) (derivado de un aminoácido ), sirve como una molécula reguladora importante para la circulación.
Rápida reacción de óxido nítrico con agua en los animales resulta en la producción de su metabolito nitrito. Animal metabolismo del nitrógeno en las proteínas, en general, da lugar a excreción de urea , mientras que el metabolismo de los animales de ácidos nucleicos resultados en la excreción de urea y acido urico. El olor característico de la decadencia carne animal es causada por la creación de cadena larga, que contienen nitrógeno las aminas , tales como putrescina y cadaverina, que son productos de la descomposición de los aminoácidos ornitina y lisina, respectivamente, en la descomposición de proteínas.
Descomposición de los organismos y sus productos de desecho puede producir pequeñas cantidades de nitrato, pero la mayoría decaimiento finalmente devuelve el contenido de nitrógeno a la atmósfera, como nitrógeno molecular. La circulación de nitrógeno de la atmósfera, a compuestos orgánicos, a continuación, de nuevo a la atmósfera, se conoce como el ciclo del nitrógeno .
Seguridad
La liberación rápida de gas nitrógeno en un espacio cerrado puede desplazar el oxígeno, y por lo tanto representa una peligro de asfixia. Esto puede suceder con algunos síntomas de alarma, ya que el ser humano cuerpo carotídeo es relativamente lento y un sistema de detección de pobres con poco oxígeno (hipoxia). Un ejemplo se produjo poco antes del lanzamiento de la primera misión del transbordador espacial en 1981, cuando dos técnicos perdieron el conocimiento (y uno de ellos murió) después de que entraron en un espacio situado en el traslado de Plataforma Mobile Launcher que se presuriza con nitrógeno puro como medida de precaución contra el fuego. Los técnicos habrían sido capaces de salir de la habitación si habían experimentado síntomas tempranos de nitrógeno respiración.
Cuando se inhala a alta presiones parciales (más de alrededor de 4 bar, encontraron a profundidades por debajo de unos 30 m de buceo), nitrógeno comienza a actuar como un agente anestésico. Puede causar narcosis de nitrógeno, un estado semi-anestesiado temporal de deterioro mental similar a la causada por óxido nitroso.
El nitrógeno también se disuelve en el grasas en el torrente sanguíneo y el cuerpo. Descompresión rápida (en particular, en el caso de los buzos de ascender demasiado rápido, o astronautas descomprimir demasiado rápidamente de presión de la cabina a la presión traje espacial) puede conducir a una condición potencialmente fatal llamada enfermedad de descompresión (anteriormente conocida como enfermedad del cajón o las curvas), cuando se forman burbujas de nitrógeno en la sangre, los nervios, las articulaciones y otras zonas sensibles o vitales. Otros gases "inertes" (los gases distintos del dióxido de carbono y oxígeno) causar los mismos efectos de burbujas compuestos por ellos, así que la sustitución del nitrógeno en los gases de respiración pueden impedir la narcosis de nitrógeno, pero no impide que la enfermedad de descompresión.
El contacto directo con la piel nitrógeno líquido causará graves congelación ("quemaduras" criogénicas). Esto puede ocurrir casi instantáneamente al entrar en contacto, o después de un segundo o más, dependiendo de la forma de nitrógeno líquido. Nitrógeno líquido a granel causa menos de congelación rápida que una pulverización de niebla de nitrógeno (tal como se utiliza para congelar ciertos crecimientos de la piel en la práctica de la dermatología). El área de superficie adicional proporcionada por los materiales de nitrógeno empapado también es importante, con la ropa empapada o algodón causando daño mucho más rápido que un derrame de líquido directo con la piel. "Contacto" completa entre la piel desnuda y grandes-gotas recogidos o piscinas de nitrógeno líquido puede ser prevenida por un segundo o dos, por una capa de aislante de gas del efecto leidenfrost. Esto puede dar a la piel un segundo de la protección de líquido a granel de nitrógeno. Sin embargo, el nitrógeno líquido se aplica a la piel en las nieblas, y en los tejidos, evita este efecto, y provoca la congelación local inmediatamente.
Los sensores de oxígeno se utilizan a veces como medida de seguridad cuando se trabaja con nitrógeno líquido para alertar a los trabajadores de los derrames de gas en un espacio confinado.
