
Lluvia ácida
Antecedentes
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. SOS patrocinio infantil es cool!
| |||||||||||||||||||||||
La lluvia ácida es lluvia o cualquier otra forma de precipitación que es inusualmente ácida . Tiene efectos nocivos sobre la medio ambiente y en las estructuras. La lluvia ácida es causada principalmente por las emisiones debidas a la actividad humana de azufre y de nitrógeno compuestos que reaccionan en la atmósfera para producir ácidos. En los últimos años, muchos gobiernos han introducido leyes para reducir estas emisiones.
Definición
El término "lluvia ácida" es comúnmente utilizado para referirse a la deposición de los componentes ácidos en la lluvia, nieve, niebla, rocío, o partículas secas. El término más exacto es "lluvia ácida". El agua destilada, que no contiene dióxido de carbono, tiene un neutral pH de 7. Los líquidos con un pH inferior a 7 son ácidos, y los que tienen un pH mayor que 7 son básicas. "Clean" o la lluvia no contaminada es ligeramente ácida, siendo su pH de aproximadamente 5,6, ya que el dióxido de carbono y agua en el aire reaccionan entre sí para formar ácido carbónico, un ácido débil.
El ácido carbónico entonces puede ionizar en el agua formando concentraciones bajas de iones hidronio:
La acidez extra en la lluvia proviene de la reacción de contaminantes de aire primario, principalmente óxidos de azufre y óxidos de nitrógeno, con agua en el aire para formar ácidos fuertes (como sulfúrico y ácido nítrico). Las principales fuentes de estos contaminantes son los vehículos y las plantas industriales y de generación de energía.
Historia
Desde la Revolución Industrial, las emisiones de dióxido de azufre y óxidos de nitrógeno a la atmósfera se han incrementado. La lluvia ácida se encontró por primera vez en Manchester , Inglaterra . En 1852, Robert Angus Smith encontró la relación entre la lluvia ácida y la contaminación atmosférica. Aunque la lluvia ácida fue descubierto en 1852, no fue hasta finales de la década de 1960 que los científicos comenzaron ampliamente observar y estudiar el fenómeno. Canadiense Harold Harvey fue de los primeros en investigar un lago "muerto". El conocimiento público de la lluvia ácida en los EE.UU. aumentó en la década de 1990 después de la New York Times promulgó informes de la Hubbard Brook Bosque Experimental en New Hampshire de los efectos ambientales nocivos miríada demostró que el resultado de la misma.
Ocasionales lecturas de pH de muy por debajo de 2,4 (la acidez de vinagre) se han reportado en las zonas industrializadas. La lluvia ácida Industrial es un problema importante en China, , Europa del Este , Rusia y las áreas a favor del viento de ellos. Estas áreas todas queman carbón que contiene azufre para generar calor y electricidad. El problema de la lluvia ácida no sólo ha aumentado con la población y el crecimiento industrial, pero se ha extendido. El uso de altas chimeneas para reducir locales contaminación ha contribuido a la difusión de la lluvia ácida por la liberación de gases en la circulación atmosférica regional. A menudo, la deposición se produce a una distancia considerable a favor del viento de las emisiones, con las regiones montañosas que tienden a recibir más (simplemente debido a su mayor precipitación). Un ejemplo de este efecto es el bajo pH de la lluvia (en comparación con las emisiones locales) que cae en Escandinavia.
Las emisiones de sustancias químicas que conducen a la acidificación
El gas más importante que conduce a la acidificación es dióxido de azufre. Las emisiones de óxidos de nitrógeno que se oxidan para formar ácido nítrico tienen una importancia creciente debido a los controles más estrictos sobre las emisiones de compuestos que contienen azufre. 70 Tg (S) al año en forma de SO2 proviene de combustibles fósiles de combustión y la industria, 2,8 Tg (S) de incendios forestales y 7-8 Tg (S) por año a partir de los volcanes .
Fenomenos Naturales
El director naturales fenómenos que contribuyen los gases que producen ácido a la atmósfera son las emisiones de los volcanes y los de biológicos procesos que ocurren en la tierra, en humedales, y en los océanos . La fuente biológica importante de compuestos que contienen azufre es sulfuro de dimetilo.
Los efectos de los depósitos ácidos se han detectado en el hielo glacial miles de años de antigüedad en partes remotas del planeta.
Actividad humana

La principal causa de la lluvia ácida es de azufre y de nitrógeno compuestos de origen humano, como la generación de electricidad, fábricas y vehículos de motor. Las plantas de energía de carbón son una de las más contaminantes. Los gases se pueden llevar a cientos de kilómetros en la atmósfera antes de que se convierten en ácidos y se depositan. En el pasado, las fábricas tenían embudos cortos para dejar salir el humo, pero esto causó muchos problemas; por lo tanto, las fábricas tienen ahora embudos de humo más largos. Sin embargo, esto hace que los contaminantes que se llevarán más lejos, causando mayor daño ecológico.
Los procesos químicos
La química en fase gaseosa
En la fase de gas dióxido de azufre se oxida por reacción con el radical a través de un hidroxilo reacción intermolecular:
- SO 2 + OH · → AGRO 2 ·
que es seguido por:
- AGRO 2 · + O2 → HO 2 · + SO3
En la presencia de agua trióxido de azufre (SO 3) se convierte rápidamente en ácido sulfúrico :
- SO3 (g) + H2O (l) → H 2 SO 4 (l)
El ácido nítrico se forma por la reacción de OH con Dioxido de nitrogeno:
- NO 2 + OH · → HNO3
Para más información ver Seinfeld y Pandis (1998).
Química en gotas de las nubes
Cuando las nubes están presentes la tasa de pérdida de SO 2 es más rápido que se puede explicar por la química en fase gaseosa solo. Esto es debido a reacciones en las gotitas de agua líquida
- Hidrólisis
El dióxido de azufre se disuelve en agua y luego, como dióxido de carbono, se hidroliza en una serie de equilibrio reacciones:
- SO 2 (g) + H2O ⇌ SO 2 · H2O
- SO 2 · H2O ⇌ H + + HSO 3 -
- HSO 3 - ⇌ H + + SO 3 2-
- Oxidación
Hay un gran número de reacciones acuosas que oxidar el azufre de S ( IV ) a S (VI), que conduce a la formación de ácido sulfúrico. Las reacciones de oxidación más importantes son con ozono , peróxido de hidrógeno y de oxígeno (reacciones con oxígeno son catalizadas por hierro y manganeso en las gotas de las nubes).
Para más información ver Seinfeld y Pandis (1998).
La deposición ácida
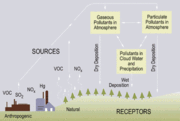
La deposición húmeda
La deposición húmeda de los ácidos se produce cuando cualquier forma de precipitación (lluvia, nieve, etc.) elimina los ácidos de la atmósfera y lo entrega a la superficie de la Tierra. Esto puede ser el resultado de la deposición de ácidos producidos en las gotas de lluvia (véase la química de fase acuosa anterior) o por la precipitación eliminación de los ácidos ya sea en o por debajo de las nubes nubes. Eliminación húmedo de ambos gases y aerosoles son tanto de importancia para la deposición húmeda.
La deposición seca
La deposición ácida también se produce a través de la deposición seca en ausencia de precipitaciones. Esto puede ser responsable de hasta un 20 a 60% de la deposición ácida total. Esto ocurre cuando las partículas y gases se adhieren al suelo, plantas u otras superficies.
Efectos adversos

La lluvia ácida se ha demostrado que tienen efectos adversos sobre los bosques, las aguas dulces y suelos, matando a las formas de vida de insectos y acuáticos, además de provocar daños en los edificios y con los posibles impactos en la salud humana.
Las aguas superficiales y animales acuáticos
Tanto la concentración de aluminio más altos en las aguas superficiales de pH más bajos y que se producen como consecuencia de la lluvia ácida pueden causar daños a los peces y otros animales acuáticos. A pHs inferiores a 5 huevos más pescado no eclosionan y pH más bajos pueden matar a los peces adultos. Como lagos se convierten se reduce la biodiversidad más ácida. La lluvia ácida ha eliminado vida de los insectos y algunas especies de peces, incluyendo la trucha de arroyo en algunos arroyos Apalaches y arroyos. Sin embargo, ha habido un cierto debate sobre el grado en que la lluvia ácida contribuye a la acidez del lago (es decir, que muchos lagos ácidos pueden resultar principalmente de las características de la cuenca circundante, y no la propia lluvia). La Web site indica que la EPA: "De los lagos y arroyos encuestados, la lluvia ácida causada acidez en el 75 por ciento de los lagos ácidos y alrededor del 50 por ciento de las corrientes ácidas".
Suelos
La biología del suelo puede verse seriamente dañada por la lluvia ácida. Algunos tropical microbios pueden consumir rápidamente los ácidos pero otros microbios son incapaces de tolerar bajo pH y son asesinados. La enzimas de estos microbios son desnaturalizado (cambiado en forma por lo que ya no funcionan) por el ácido. Los iones hidronio de la lluvia ácida también movilizan toxinas y lixiviar los nutrientes y minerales esenciales
- 2 H + (aq) + Mg 2 + (arcilla) ⇌ 2H + (arcilla) + Mg 2+ (aq)
Los bosques y otros tipos de vegetación

Los efectos adversos pueden ser indirectamente relacionados con la lluvia ácida, como los efectos del ácido en el suelo (ver más arriba) o alta concentración de precursores gaseosos a la lluvia ácida. Bosques de gran altitud son especialmente vulnerables ya que a menudo rodeados de nubes y la niebla que son más ácidas que la lluvia.
Otras plantas también pueden ser dañados por la lluvia ácida pero el efecto sobre los cultivos de alimentos se minimiza mediante la aplicación de fertilizantes para reemplazar los nutrientes perdidos. En las zonas cultivadas, piedra caliza también se puede añadir para aumentar la capacidad del suelo para mantener el pH estable, pero esta táctica es en gran parte no utilizable en el caso de las tierras silvestres. La lluvia ácida agota minerales del suelo y luego se impide el crecimiento de la planta.
Salud humana
Algunos científicos han sugerido vínculos directos para la salud humana, pero ninguna ha sido probada .. Sin embargo, partículas finas, una gran parte de los cuales se forman a partir de los mismos gases como la lluvia ácida (dióxido de azufre y dióxido de nitrógeno), se ha demostrado que causa la enfermedad y muertes prematuras, como el cáncer y otras enfermedades mortales Para obtener más información sobre los efectos en la salud de aerosol ver efectos en la salud de partículas.
Otros efectos adversos

La lluvia ácida también puede causar daño a ciertos materiales de construcción y los monumentos históricos. Esto es porque el ácido sulfúrico en la lluvia reacciona químicamente con los compuestos de calcio en las piedras (piedra caliza, arenisca, mármol y granito) para crear el yeso, que luego se descascara.
- CaCO 3 (s) + H 2 SO 4 (aq) ⇌ CaSO 4 (ac) + CO 2 (g) + H 2 O (l)
Esto también se ve comúnmente en las lápidas antiguas donde la lluvia ácida puede causar la inscripción para convertirse completamente ilegible. La lluvia ácida también causa un aumento de la tasa de oxidación de hierro. La visibilidad también se reduce por el sulfato y nitrato en la atmósfera.
Las áreas afectadas
Lugares especialmente afectados en todo el mundo incluyen la mayor parte de Europa (en particular Escandinavia, con muchos lagos con agua ácida que no contienen vida y muchos árboles muertos) muchas partes del Estados Unidos (estados como Nueva York están muy gravemente afectada) y Suroeste de Canadá . Otras áreas afectadas son la costa este del sur de China, y Taiwán .
Áreas de problemas potenciales en el futuro
Lugares como gran parte de Asia del Sur ( Indonesia , Malasia y Tailandia ), Western Sudáfrica (el país), el sur de la India y Sri Lanka e incluso África occidental (países como Ghana , Togo ] y Nigeria ) todos podrían ser propensos a la lluvia ácida en el futuro.
Los métodos de prevención
Soluciones técnicas
En los Estados Unidos, muchos de combustión de carbón centrales eléctricas utilizan Desulfuración de gases de combustión (FGD) para eliminar los gases que contienen azufre de sus gases de chimenea. Un ejemplo de FGD es el lavador de gases que se utiliza comúnmente en los EE.UU. y muchos otros países. Un lavador de gases es básicamente una torre de reacción equipado con un ventilador que extrae los gases de chimenea de humo caliente de una planta de energía en la torre. Cal o piedra caliza en forma de suspensión también se inyecta en la torre para mezclarse con los gases de chimenea y combinar con el dióxido de azufre presente. El carbonato de calcio de la piedra caliza produce sulfato de calcio de pH neutro que se elimina físicamente de la torre de lavado. Es decir, el depurador convierte la contaminación de azufre a sulfatos industriales.
En algunas zonas, los sulfatos se venden a empresas químicas como yeso cuando la pureza del sulfato de calcio es alto. En otros, se colocan en vertedero. Sin embargo, los efectos de la lluvia ácida pueden durar por generaciones, como los efectos del cambio de nivel de pH pueden estimular la lixiviación continua de productos químicos indeseables en las fuentes de agua de otra manera prístinos, matando a especies de insectos y peces vulnerables y bloquear los esfuerzos para restaurar la vida de los nativos.
Control de las emisiones de automóviles reduce las emisiones de óxidos de nitrógeno de los vehículos de motor.
Los tratados internacionales
Varios tratados internacionales sobre el transporte de larga distancia de los contaminantes atmosféricos se han acordado por ejemplo, Reducción de las emisiones de azufre Protocolo bajo el Convenio sobre la contaminación atmosférica transfronteriza a gran distancia.
El comercio de emisiones
Un esquema regulatorio más reciente involucra comercio de emisiones. En este esquema, todas las facilidades contaminantes actual se da un certificado de emisiones que se convierte en parte de los bienes de equipo. Operadores pueden instalar equipos de control de la contaminación, y vender partes de sus licencias de emisión. La intención de esto es dar a los operadores de los incentivos económicos para instalar controles de contaminación.
