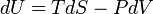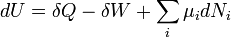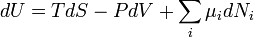Primera ley de la termodinámica
Antecedentes
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
| La ley de la termodinámica |
|---|
| Ley Cero |
| Primera ley |
| Segunda ley |
| Tercera ley |
| Relación fundamental |
En termodinámica , la primera ley de la termodinámica es una expresión de la ley física más universal de la conservacion de energia. Sucintamente, la primera ley de la termodinámica establece:
| " | El aumento de la energía interna de un sistema es igual a la cantidad de energía añadida por el calentamiento del sistema, menos la cantidad que se pierde como resultado de la labor realizada por el sistema en su entorno. | " |
Descripción
La primera ley de la termodinámica, básicamente, establece que un sistema termodinámico puede almacenar o mantener la energía y que esta interna de energía se conserva. El calor es un proceso por el cual la energía se añade a un sistema desde una fuente de alta temperatura, o se pierde a una baja temperatura hundirse. Además, la energía puede ser perdido por el sistema cuando lo hace el trabajo mecánico sobre su entorno, o por el contrario, puede ganar energía como resultado del trabajo realizado sobre el mismo por sus alrededores. La primera ley establece que esta energía se conserva: El cambio en la energía interna es igual a la cantidad añadida por calentamiento menos la cantidad perdida por hacer un trabajo sobre el medio ambiente. La primera ley puede establecer matemáticamente como:
donde  es un pequeño aumento de la energía interna del sistema,
es un pequeño aumento de la energía interna del sistema,  es una pequeña cantidad de calor añadido al sistema, y
es una pequeña cantidad de calor añadido al sistema, y  es una pequeña cantidad de trabajo realizado por el sistema. Como una analogía, si el calor fuera dinero, entonces podríamos decir que cualquier cambio en nuestros ahorros (
es una pequeña cantidad de trabajo realizado por el sistema. Como una analogía, si el calor fuera dinero, entonces podríamos decir que cualquier cambio en nuestros ahorros (  ) Es igual al dinero que ponemos en (
) Es igual al dinero que ponemos en (  ) Menos el dinero que gastamos (
) Menos el dinero que gastamos (  ).
).
Los δ antes de los términos de calor y trabajo se utilizan para indicar que describen un incremento de la energía que ha de ser interpretado de manera algo diferente que el incremento de la energía interna dU. El trabajo y el calor son procesos que se suman o se restan de la energía, mientras que el U interior de la energía es una forma particular de energía asociada con el sistema. Así, el término "energía térmica" para  significa "esa cantidad de energía añade como el resultado del calentamiento" en lugar de referirse a una forma particular de energía. Asimismo, el término "energía de trabajo" para
significa "esa cantidad de energía añade como el resultado del calentamiento" en lugar de referirse a una forma particular de energía. Asimismo, el término "energía de trabajo" para  significa "esa cantidad de energía perdida como el resultado del trabajo". El resultado más significativo de esta distinción es el hecho de que se puede establecer claramente la cantidad de energía interna poseído por un sistema termodinámico, pero no se puede decir la cantidad de energía ha fluido hacia dentro o fuera del sistema como resultado de su ser calentado o enfriado , ni como el resultado del trabajo que se realiza en o por el sistema.
significa "esa cantidad de energía perdida como el resultado del trabajo". El resultado más significativo de esta distinción es el hecho de que se puede establecer claramente la cantidad de energía interna poseído por un sistema termodinámico, pero no se puede decir la cantidad de energía ha fluido hacia dentro o fuera del sistema como resultado de su ser calentado o enfriado , ni como el resultado del trabajo que se realiza en o por el sistema.
La primera declaración explícita de la primera ley de la termodinámica fue dada por Rudolf Clausius en 1850 : "No es una función de estado E, llamada" energía ", cuyo diferencial es igual al trabajo intercambiada con el entorno durante una proceso adiabático ".
Tenga en cuenta que la formulación anterior se ve favorecida por ingenieros y físicos. Los químicos prefieren una segunda forma, en la que el término trabajo  se define como el trabajo realizado sobre el sistema, y por lo tanto insertar un signo más en la ecuación anterior antes del término del trabajo. En este artículo se utilizará la primera definición exclusivamente.
se define como el trabajo realizado sobre el sistema, y por lo tanto insertar un signo más en la ecuación anterior antes del término del trabajo. En este artículo se utilizará la primera definición exclusivamente.
Formulación matemática
La expresión matemática de la primera ley está dada por:
donde  es el aumento infinitesimal en la energía interna del sistema,
es el aumento infinitesimal en la energía interna del sistema,  es la cantidad infinitesimal de calor añadido al sistema, y
es la cantidad infinitesimal de calor añadido al sistema, y  es la cantidad infinitesimal de trabajo realizado por el sistema. El calor infinitesimal y el trabajo se denotan por δ en lugar de d, ya que, en términos matemáticos, no son diferenciales exactas. En otras palabras, no describen el estado de cualquier sistema. La integral de un diferencial inexacta depende de la "ruta" particular, tomada a través del espacio de parámetros termodinámicos, mientras que la integral de una diferencial exacta depende solamente de los estados inicial y final. Si los estados inicial y final son los mismos, entonces la integral de un diferencial inexacta puede o no puede ser cero, pero la integral de una diferencial exacta siempre será cero. El camino tomado por un sistema termodinámico a través del espacio estado se conoce como un proceso termodinámico.
es la cantidad infinitesimal de trabajo realizado por el sistema. El calor infinitesimal y el trabajo se denotan por δ en lugar de d, ya que, en términos matemáticos, no son diferenciales exactas. En otras palabras, no describen el estado de cualquier sistema. La integral de un diferencial inexacta depende de la "ruta" particular, tomada a través del espacio de parámetros termodinámicos, mientras que la integral de una diferencial exacta depende solamente de los estados inicial y final. Si los estados inicial y final son los mismos, entonces la integral de un diferencial inexacta puede o no puede ser cero, pero la integral de una diferencial exacta siempre será cero. El camino tomado por un sistema termodinámico a través del espacio estado se conoce como un proceso termodinámico.
Una expresión de la primera ley puede escribirse en términos de diferenciales exactas por darse cuenta de que el trabajo que un sistema hace es igual a su presión el cambio infinitesimal en su volumen. En otras palabras  donde
donde  es presión y
es presión y  es el volumen . Para un proceso reversible, la cantidad total de calor añadido a un sistema se puede expresar como
es el volumen . Para un proceso reversible, la cantidad total de calor añadido a un sistema se puede expresar como  donde
donde  es la temperatura y
es la temperatura y  es la entropía . Para un proceso reversible, la primera ley ahora es susceptible de actualizarse:
es la entropía . Para un proceso reversible, la primera ley ahora es susceptible de actualizarse:
En el caso donde el número de partículas en el sistema no es necesariamente constante y puede ser de diferentes tipos, la primera ley está escrito:
donde  es el número (pequeño) de partículas de tipo i añadido al sistema, y
es el número (pequeño) de partículas de tipo i añadido al sistema, y  es la cantidad de energía añadida al sistema cuando se añade una partícula de tipo i, donde la energía de la partícula es tal que el volumen y la entropía del sistema se mantiene sin cambios.
es la cantidad de energía añadida al sistema cuando se añade una partícula de tipo i, donde la energía de la partícula es tal que el volumen y la entropía del sistema se mantiene sin cambios.  se conoce como el potencial químico de las partículas de tipo i en el sistema. La declaración de la primera ley para procesos reversibles, con diferenciales exactas es ahora:
se conoce como el potencial químico de las partículas de tipo i en el sistema. La declaración de la primera ley para procesos reversibles, con diferenciales exactas es ahora:
Una idea útil de la mecánica es que la energía adquirida por una partícula es igual a la fuerza aplicada a la partícula multiplicada por el desplazamiento de la partícula mientras se aplica esa fuerza. Consideremos ahora la primera ley sin el término de calefacción:  . La presión P se puede ver como una fuerza (y de hecho tiene unidades de fuerza por unidad de área), mientras que dV es el desplazamiento (con unidades de área veces la distancia). Podemos decir, con respecto a este término trabajo, que una diferencia de presión en una transferencia de volumen, y que el producto de los dos (de trabajo) es la cantidad de energía transferida como resultado del proceso.
. La presión P se puede ver como una fuerza (y de hecho tiene unidades de fuerza por unidad de área), mientras que dV es el desplazamiento (con unidades de área veces la distancia). Podemos decir, con respecto a este término trabajo, que una diferencia de presión en una transferencia de volumen, y que el producto de los dos (de trabajo) es la cantidad de energía transferida como resultado del proceso.
Es útil para ver el término de TSD en la misma luz: Con respecto a este término de calor, una diferencia de temperatura fuerza una transferencia de entropía, y el producto de los dos (calor) es la cantidad de energía transferida como resultado del proceso de . Aquí, la temperatura se conoce como una fuerza "generalizado" (en lugar de una fuerza mecánica real) y la entropía es un desplazamiento generalizado.
Del mismo modo, una diferencia de potencial químico entre grupos de partículas en el sistema fuerza un trasfer de partículas, y el correspondiente producto es la cantidad de energía transferida como resultado del proceso. Por ejemplo, considere un sistema que consta de dos fases: agua líquida y vapor de agua. Hay una "fuerza" generalizada de la evaporación que impulsa las moléculas de agua fuera del líquido. Hay una "fuerza" generalizada de condensación que impulsa las moléculas de vapor de vapor. Sólo cuando estos dos "fuerzas" (o potenciales químicos) son iguales ¿habrá equilibrio, y la transferencia neta será cero.
Los dos parámetros termodinámicos que forman un par de fuerza-desplazamiento generalizado se denominan "variables conjugadas". Los dos pares más conocidos son, por supuesto, la presión-volumen y la temperatura-entropía.
Tipos de procesos termodinámicos
Caminos a través del espacio de variables termodinámicas se especifican a menudo manteniendo constantes ciertas variables termodinámicas. Es útil agrupar estos procesos en pares, en los que cada variable se mantiene constante es un miembro de un par conjugado.
El par conjugado de presión-volumen se refiere a la transferencia de energía mecánica o dinámica como el resultado del trabajo.
- Un proceso isobárico se produce a presión constante. Un ejemplo sería tener un pistón móvil en un cilindro, de modo que la presión dentro del cilindro está siempre a la presión atmosférica, aunque se encuentra aislado de la atmósfera. En otras palabras, el sistema está conectado dinámicamente, por un límite móvil, a un depósito de presión constante.
- Un proceso isócoro es uno en el que el volumen se mantiene constante, lo que significa que el trabajo realizado por el sistema será cero. De ello resulta que, por el simple sistema de dos dimensiones, cualquier energía calorífica transferida al sistema externamente será absorbida como energía interna. Un proceso isócoro también se conoce como un proceso isométrica. Un ejemplo sería colocar una lata cerrada que contiene sólo el aire al fuego. En una primera aproximación, la lata no se expandirá, y el único cambio será que el gas gana energía interna, como lo demuestra su aumento de la temperatura y la presión. Matemáticamente,
 . Podemos decir que el sistema está aislado de forma dinámica, por un límite rígido, desde el entorno
. Podemos decir que el sistema está aislado de forma dinámica, por un límite rígido, desde el entorno
El par conjugado de temperatura-entropía se refiere a la transferencia de energía térmica como resultado de calefacción.
- Un proceso isotérmico se produce a una temperatura constante. Un ejemplo sería tener un sistema inmerso en un gran baño de temperatura constante. Toda la energía de trabajo realizado por el sistema se perderá al baño, pero su temperatura se mantendrá constante. En otras palabras, el sistema está térmicamente conectado, por un límite térmicamente conductor a un depósito a temperatura constante.
- Un proceso isentrópico se produce a una entropía constante. Para un proceso reversible esto es idéntico a un proceso adiabático (ver abajo). Si un sistema tiene una entropía que aún no ha alcanzado su valor máximo equilibrio, un proceso de enfriamiento puede ser necesario para mantener ese valor de la entropía.
- Un proceso adiabático es un proceso en el que no hay energía añadida o sustraída desde el sistema de calefacción o refrigeración. Para un proceso reversible, esto es idéntico a un proceso isentrópico. Podemos decir que el sistema está térmicamente aislado de su medio ambiente y que su límite es un aislante térmico. Si un sistema tiene una entropía que aún no ha alcanzado su valor máximo equilibrio, la entropía aumentará aunque el sistema está aislado térmicamente.
Todo lo anterior ha supuesto implícitamente que los límites también son impermeables a partículas. Podemos suponer límites que son a la vez rígido y térmicamente aislante, pero son permeables a uno o más tipos de partículas. Consideraciones similares se mantienen para la (potencial químico) - (número de partículas) pares conjugados.