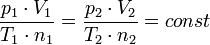La ley de Avogadro
Sabías ...
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. Infantil SOS es la mayor donación de caridad del mundo niños huérfanos y abandonados de la oportunidad de la vida familiar.
La ley de Avogadro (Hipótesis de Avogadro o Principio de Avogadro) es un ley de los gases nombrado después Amedeo Avogadro, quien en 1811 planteó la hipótesis de que:
- Volúmenes iguales de gases ideales o perfectos, a la misma temperatura y presión, contienen el mismo número de partículas o moléculas.
Por lo tanto, el número de moléculas en una específica de volumen de gas es independiente del tamaño o la masa de las moléculas de gas cuando se refieren a una aproximado de los gases ideales. Es muy importante tener en cuenta que aplicamos un gas ideal o definición gas perfecto (un gas hipotético que consta de partículas idénticas de volumen cero, sin fuerzas intermoleculares, pero la capacidad de intercambiar impulso con moléculas de gas idénticos) a un gas real, tales como hidrógeno o nitrógeno para que podamos aproximar estadísticamente el comportamiento del gas real.
Como ejemplo, volúmenes iguales de molecular de hidrógeno y nitrógeno contendrían el mismo número de moléculas, siempre que estén a la misma temperatura y presión y observar el comportamiento ideal o perfecta gas. Si bien este no es el caso mundo real, es estadísticamente muy cerca.
El aspecto menor de la ley puede establecer matemáticamente como:
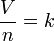 .
.
donde:
- V es el volumen del gas.
- n es el número de moles en el gas.
- k es una constante de proporcionalidad.
Sin embargo, esta ecuación anterior es sólo un trivial, que es válido para todas las sustancias homogéneas, incluyendo líquidos homogéneos y sólidos. Esta relación es fácil deducir; su validez fue asumido antes del trabajo de Avogadro.
La consecuencia más importante de la ley de Avogadro es la siguiente: La constante de los gases ideales tiene el mismo valor para todos los gases. Esto significa que la constante
donde:
- p es el presión del gas
- T es la temperatura del gas
tiene el mismo valor para todos los gases, independiente del tamaño o la masa de las moléculas de gas. Esta afirmación no es trivial, y encarna una visión ingeniosa de Avogadro en la naturaleza de gases ideales. Tuvieron que pasar décadas para demostrar la ley de Avogadro basado en la la teoría cinética de los gases.
Un mol de un gas ideal ocupa 22,4 litros (dm³) a STP, y ocupa 24,45 litros en el SATP (Standard Temperatura ambiente y de presión = 25 ° C y 1 atm / 101,3 kPa). Este volumen se refiere a menudo como la volumen molar de un gas ideal. Los gases reales pueden diferir de dicho valor.
El número de moléculas en un mol se llama el número de Avogadro : aproximadamente 6.022 × 10 23 partículas por mol.
La ley de Avogadro, junto con el combina ley de los gases, forma la ley de los gases ideales.