
Nitrato
Antecedentes de las escuelas de Wikipedia
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| Nitrato | |
|---|---|
 | |
 |  |
Nitrato | |
| Propiedades | |
| Fórmula molecular | NO - 3 |
| Masa molar | 62,0049 g mol -1 |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
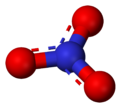
El nitrato es una ion poliatómico con la fórmula molecular NO 3 - y una masa molecular de 62,0049 g / mol. Los nitratos también describir lo orgánico grupo funcional SRNO 2. Estos ésteres de nitrato son una clase especial de explosivos.
Estructura

El anión es el base conjugada del ácido nítrico , que consta de un centro de nitrógeno átomo rodeado por tres átomos de oxígeno unidos de manera idéntica en una disposición plana trigonal. El ion nitrato lleva una cargo formal de -1. Esto resulta de una carga formal combinación en la que cada uno de los tres oxígenos lleva a - 2/3 carga, mientras que el nitrógeno tiene una carga 1, todos estos sumar a la carga formal del ion nitrato poliatómico. Esta disposición se utiliza comúnmente como un ejemplo de resonancia. Como el isoelectrónico carbonato de iones, el ion nitrato puede ser representado por estructuras de resonancia:
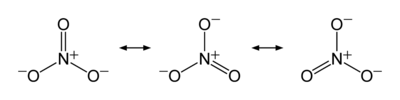
Propiedades

Casi todas las sales de nitratos inorgánicos son solubles en agua en temperatura y presión estándar. Un ejemplo común de una sal de nitrato inorgánico es nitrato de potasio (salitre).
Aparición
Sales de nitrato se encuentran naturalmente en la tierra como grandes depósitos, en particular de Chile salitre una importante fuente de nitrato de sodio.
Los nitritos son producidos por un número de especies de bacterias nitrificantes, y los compuestos de nitrato de pólvora (consulte este tema para obtener más) fueron producidos históricamente, en ausencia de fuentes de nitratos minerales, por medio de diversos procesos de fermentación utilizando la orina y el estiércol.
Usos
Los nitratos se producen principalmente para su uso como fertilizantes en la agricultura debido a su alta solubilidad y biodegradabilidad. Los principales son los nitratos de amonio, sodio, potasio y sales de calcio. Varios millones de kilogramos se producen anualmente para este propósito.
Otros usos
La segunda aplicación importante de nitratos como agentes oxidantes, principalmente en explosivos, donde la rápida oxidación de compuestos de carbono libera grandes volúmenes de gases (véase la pólvora para un ejemplo). El nitrato de sodio se utiliza para eliminar las burbujas de aire a partir de vidrio fundido y algunas cerámicas. Las mezclas de la sal fundida se utilizan para endurecer algunos metales.
Detección
Iones nitrato libre en solución pueden ser detectados por un nitrato electrodo selectivo de iones. Tales electrodos de forma análoga a la electrodo selectivo de pH. Esta respuesta se describe parcialmente por el Ecuación de Nernst.
Toxicidad
Toxicosis
Toxicosis nitrato puede ocurrir a través de metabolismo enterohepática de nitrato a nitrito es un intermedio. Los nitritos oxidar el hierro átomos en la hemoglobina de ferroso hierro (2+) a hierro férrico (3+), haciéndolo incapaz de transportar oxígeno. Este proceso puede llevar a generalizada la falta de oxígeno en el tejido del órgano y una condición peligrosa llamada metahemoglobinemia. Aunque el nitrito se convierte en amoniaco , si hay más de nitrito que se puede convertir, el animal sufre lentamente de una falta de oxígeno.
Efectos para la salud humana
Los seres humanos están sujetos a la toxicidad del nitrato, con los bebés son especialmente vulnerables a la metahemoglobinemia, debido a que metaboliza nitrato triglicéridos presentes en concentraciones más altas que en otras etapas de desarrollo. La metahemoglobinemia en lactantes se conoce como El síndrome del bebé azul. Aunque los nitratos en el agua potable se pensaban ser un factor que contribuye, ahora hay dudas científicas significativas en cuanto a si existe una relación de causalidad. El síndrome del bebé azul ahora se piensa que es el producto de una serie de factores, que puede incluir cualquier factor que causa malestar gástrico, como una infección diarreica, intolerancia a la proteína, toxicidad de metales pesados, etc., con los nitratos jugando un papel menor. Los nitratos, si un factor en un caso concreto, lo más a menudo ser ingerido por los bebés en el agua potable de alta nitrato. Sin embargo, la exposición de nitrato también puede ocurrir si la alimentación, por ejemplo, las verduras que contiene altos niveles de nitrato. Lechuga puede contener nitrato bajo condiciones de crecimiento elevadas, tales como la luz solar reducida, insuficiente de la micronutrientes esenciales de molibdeno (Mo) y el hierro (Fe), o altas concentraciones de nitrato, debido a la reducción de la asimilación de nitrato en la planta. Los altos niveles de nitrato de la fertilización también contribuyen a niveles elevados de nitrato en la planta cosechada.
Algunos adultos pueden ser más susceptibles a los efectos de nitrato que otros. La metahemoglobina reductasa enzima puede ser poco producidas o ausente en ciertas personas que tienen una mutación hereditaria. Estas personas no pueden descomponer metahemoglobina tan rápidamente como los que tienen la enzima, lo que lleva a un aumento de los niveles circulantes de metahemoglobina (lo que implica que su sangre no es tan rica en oxígeno). Los que tienen el ácido del estómago insuficiente (incluyendo algunos vegetarianos y veganos) también pueden estar en riesgo. Es el mayor consumo de vegetales de hojas verdes que normalmente acompañan a este tipo de dietas puede conducir a un aumento de la ingesta de nitratos. Una amplia variedad de condiciones médicas, incluyendo alergias a los alimentos, asma, hepatitis y cálculos biliares pueden ser vinculados con baja acidez de estómago; Estos individuos también pueden ser altamente sensibles a los efectos de nitrato.
La metahemoglobinemia se puede tratar con azul de metileno, que reduce el hierro férrico (3+) en células sanguíneos afectados de nuevo a hierro ferroso (2+).
Toxicidad Marino

En de agua dulce o sistemas estuarinos cercanos a la tierra, nitrato pueden alcanzar altos niveles que potencialmente pueden causar la muerte de los peces. Mientras que el nitrato es mucho menos tóxico que el amoníaco, los niveles de más de 30 ppm de nitrato puede inhibir el crecimiento, deteriorar el sistema inmune y causan estrés en algunas especies acuáticas. Sin embargo, a la luz de los problemas inherentes a los protocolos anteriores en experimentos de toxicidad aguda de nitrato, el grado de toxicidad de nitrato ha sido objeto de debate reciente.
En la mayoría de los casos de las concentraciones de nitratos en exceso en los sistemas acuáticos, la fuente principal es escorrentía superficial de la agricultura o ajardinadas áreas que han recibido el exceso de fertilizante de nitrato. Se llama eutrofización y puede conducir a la proliferación de algas. Así como líder al agua anoxia y zonas muertas, estas floraciones pueden causar otros cambios en la función del ecosistema, favoreciendo algunos grupos de organismos sobre los demás. Como consecuencia, como nitrato forma un componente de de sólidos totales disueltos, que son ampliamente utilizados como un indicador de calidad del agua.
El nitrato es también un subproducto de sistemas sépticos. En concreto, se trata de una sustancia química natural que queda después de la ruptura o descomposición de desechos animales o humanos. La calidad del agua también puede verse afectada a través de recursos de agua subterránea que tienen un alto número de sistemas sépticos en una cuenca. Septics lixiviación hacia abajo en los recursos o los acuíferos de agua subterránea y de suministro de cuerpos de agua cercanos. Lagos que dependen de las aguas subterráneas son a menudo afectadas por la nitrificación a través de este proceso.
El nitrato en el agua potable a niveles por encima de la norma nacional representa una amenaza inmediata para los niños pequeños. Los niveles excesivos pueden resultar en una condición conocida como " El síndrome del bebé azul ". Si no se trata, la condición puede ser fatal. Hervir el agua contaminada con nitratos aumenta la concentración de nitratos y el riesgo potencial.
Toxicidad de nitratos en el ganado
Intoxicación por nitrato es una preocupación para los productores de ganado, principalmente, pero también para otros productores de rumiantes. El nitrato se consume de forma natural por el cultivo de plantas; sin embargo, cuando se interrumpe el crecimiento, las raíces de las plantas seguirán tomar hasta nitrato del suelo, y salvo que se produzca un nuevo crecimiento de la planta, el nitrato se acumularán. Por lo tanto, la cosecha después de los resultados acumulación de nitratos en un cultivo con alto contenido de nitratos. Los factores que pueden causar la acumulación de nitratos en las plantas son las heladas, granizo, sequía, vientos secos y cálidos, el daño de pesticidas, herbicidas y daños de cualquier otra planta baja talla causas ambientales.
Los síntomas de envenenamiento por nitrato incluyen aumento del ritmo cardíaco y la respiración; en casos avanzados de la sangre y el tejido se ponga de color azul o marrón. RSS puede ser probado para el nitrato; el tratamiento consiste en complementar o sustituir los suministros existentes con material de nitrato inferior. Los niveles seguros de nitrato de varios tipos de ganado son los siguientes:
| Categoría | % NO 3 | % NO 3 -N | % KNO3 | Efectos |
|---|---|---|---|---|
| 1 | <0,5 | <0,12 | <0,81 | Generalmente seguro para el ganado vacuno y ovino |
| 2 | 0.5-1.0 | ,12-0,23 | 0,81-1,63 | Precaución - algunos síntomas subclínicos puede aparecer en yeguas preñadas, ovejas y ganado vacuno |
| 3 | 1.0 | 0.23 | 1.63 | Problemas altos de nitrato - pérdidas por muerte y abortos pueden ocurrir en el ganado vacuno y ovino |
| 4 | <1,23 | <0,28 | <2,00 | Nivel máximo de seguridad para los caballos. No alimente a los forrajes altos de nitratos a yeguas preñadas |
Los valores de arriba son en un (libre de humedad) en base seca.
Resumen Nitrato
| HNO 3 | Él | |||||||||||||||||
| LiNO3 | Sé (NO 3) 2 | B (NO 3) 3 | C | N | O | F | Nebraska | |||||||||||
| NaNO3 | Mg (NO 3) 2 | Al (NO 3) 3 | Si | P | S | ClONO 2 | Arkansas | |||||||||||
| KNO3 | Ca (NO 3) 2 | Sc (NO 3) 3 | Ti | V | Cr (NO 3) 3 | Mn (NO 3) 2 | Fe (NO 3) 3 | Co (NO 3) 2 | Ni (NO 3) 2 | Cu (NO 3) 2 | Zn (NO 3) 2 | Georgia | Ge | Como | Se | Br | Kr | |
| RBNO 3 | Sr (NO 3) 2 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd (NO 3) 2 | AgNO3 | Cd (NO3) 2 | En | Sn | Sb | Te | CI | Xe | |
| CSNO 3 | Ba (NO 3) 2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg (NO 3) 2 | Tl | Pb (NO 3) 2 | Bi | Correos | En | Rn | ||
| Fr | Ra | Rf | Db | Mx | Bh | Hs | Montana | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Ue | Gd (NO3) 3 | Tuberculosis | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Corriente alterna | Th | Papá | UO 2 (NO 3) 2 | Np | Pu | Soy | Cm | Bk | Cf | Es | Fm | Maryland | No | Lr | ||||
