Amoníaco
Antecedentes de las escuelas de Wikipedia
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. El patrocinio de los niños ayuda a los niños en el mundo en desarrollo para aprender también.
| Amoníaco | |
|---|---|
 | |
 |  |
Azane | |
Otros nombres Nitruro de hidrógeno Trihidrógeno nitruro | |
| Identificadores | |
| CAS | 7664-41-7 |
| PubChem | 222 |
| Propiedades físicas | 217 |
| UNII | 5138Q19F1X |
| Número CE | 231-635-3 |
| Número ONU | 1005 |
| KEGG | D02916 |
| MeSH | Amoníaco |
| ChEBI | CHEBI: 16134 |
| ChEMBL | CHEMBL1160819 |
| Número RTECS | BO0875000 |
| Beilstein Referencia | 3587154 |
| Gmelin Referencia | 79 |
| 3DMet | B00004 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | NH 3 |
| Masa molar | 17.031 g / mol |
| Apariencia | Gas incoloro con un fuerte olor acre |
| Densidad | 0,86 kg / m 3 (1.013 bar en el punto de ebullición) 0,73 kg / m 3 (1.013 bar a 15 ° C) 681,9 kg / m 3 a -33,3 ° C (líquido) 817 kg / m 3 a -80 ° C (transparente sólido) |
| Punto de fusion | -77.73 ° C, 195 K, -108 ° F |
| Punto de ebullicion | -33.34 ° C, 240 K, -28 ° F |
| Solubilidad en agua | 47% (0 ° C) 31% (25 ° C) 28% (50 ° C) |
| Acidez (p K a) | 32.5 (-33 ° C), 10,5 (DMSO) |
| Basicidad (p K b) | 4.75 |
| Estructura | |
| Forma molecular | Pirámide trigonal |
| Momento bipolar | 1.42 D |
| Termoquímica | |
| Std entalpía de formación Δ f H | -46 KJ mol -1 |
| Molar estándar entropía S | 193 J · mol -1 · K -1 |
| Peligros | |
| MSDS | MSDS externa |
| Pictogramas del SGA |     |
| Indicaciones de peligro del SGA | H221, H280, H314, H331, H400 |
| Prudencia del SGA | P210, P261, P273, P280, P305 + 351 + 338, P310 |
| Índice de la UE | 007-001-00-5 (anhidro) 007-001-01-2 (soluciones) |
| Clasificación de la UE | |
| Frases R | R10, R23, R34, R50 |
| Frases S | (S1 / 2), S9, S16, S26, S36 / 37/39, S45, S61 |
| NFPA 704 |  1 3 0 |
| Punto de inflamabilidad | gas inflamable (ver texto) |
| Autoignición temperatura | 651 ° C |
| Límites de explosividad | 15-28% |
| EE.UU. Permisible límite de exposición (PEL) | 50 ppm (25 ppm ACGIH = TLV; 35 ppm STEL) |
| Compuestos relacionados | |
| Otros cationes | La fosfina Arsina Estibina |
| Hidruros de nitrógeno relacionados | La hidrazina Ácido hidrazoico |
| Compuestos relacionados | Hidróxido de amonio |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
Amoníaco o azane es un compuesto de nitrógeno y de hidrógeno con la fórmula NH 3. Es un incoloro gas con una característica acre olor. Amoniaco contribuye significativamente a los nutricionales necesidades de los organismos terrestres, al servir como un precursor de los alimentos y los fertilizantes . El amoníaco, ya sea directa o indirectamente, también es un bloque de construcción para la síntesis de muchos farmacéuticos y se utiliza en muchos productos de limpieza comerciales. Aunque en amplio uso, el amoníaco es tanto cáustica y peligrosos. Se prevé que la producción mundial de amoniaco para el año 2012 a ser 198 millones de toneladas, un aumento del 35% en el 2006 la producción mundial estimada de 146,5 millones de toneladas.
El amoníaco, como se usa comercialmente, a menudo se llama amoníaco anhidro. Este término hace hincapié en la ausencia de agua en el material. Debido NH 3 hierve a -33,34 ° C (-28.012 ° F) a una presión de 1 atmósfera, el líquido debe ser almacenado a alta presión o a baja temperatura. El amoníaco casero o hidróxido de amonio es una solución de NH 3 en agua. La concentración de este tipo de soluciones se mide en unidades de la Escala Baumé ( densidad ), con 26 grados Baumé (alrededor de 30% (en peso) de amoníaco a 15,5 ° C) que es el producto comercial de alta concentración típica.
Presencia natural
El amoníaco se encuentra en cantidades traza en la atmósfera, siendo producido a partir de la putrefacción (proceso de descomposición) de la materia vegetal y animal y nitrogenados. Sales de amonio y de amonio también se encuentran en pequeñas cantidades en el agua de lluvia, mientras cloruro de amonio (sal amoniaco), y sulfato de amonio se encuentran en los distritos volcánicos; cristales de bicarbonato de amonio se han encontrado en Patagón guano. Los riñones secretan NH 3 para neutralizar el exceso de ácido. Sales de amonio también se encuentran distribuidos por todo el suelo fértil y en agua de mar. Las sustancias que contiene amoníaco, o los que son similares a la misma, se llama amoniacal. El amoníaco se encuentra en Plutón , Júpiter y, en pequeñas cantidades, en Urano .
Propiedades
El amoníaco es un gas incoloro gas con un olor acre característico. Es más ligero que el aire, siendo su densidad de 0,589 veces la de aire . Se licúa fácilmente debido a la fuerte enlace de hidrógeno entre las moléculas; el líquido hierve a -33,3 ° C, y se congela a -77,7 ° C a cristales blancos.
El amoníaco puede ser convenientemente desodoriza haciéndolo reaccionar con cualquiera de bicarbonato de sodio o ácido acético. Ambas de estas reacciones forman una sal de amonio inodoro.
- Sólido
- La simetría cristalina es cúbica, Pearson símbolo CP16, grupo espacial P2 1 3 No.198, constante de red 0.5125 nm.
- Líquido
- Líquido amoníaco posee fuertes ionizantes poderes que reflejan su alto ε 22. Líquido de amoniaco tiene un muy alto cambio de entalpía estándar de vaporización (23.35 kJ / mol, cf. agua 40,65 kJ / mol, metano 8,19 kJ / mol, fosfina 14.6 kJ / mol) y por lo tanto puede ser utilizado en los laboratorios en los vasos no aislados sin refrigeración adicional. Véase también la sección El amoníaco líquido como solvente .
- Propiedades disolventes
- El amoníaco es miscible con agua. En una solución acuosa, puede ser expulsado por ebullición. La acuosa solución de amoniaco es básica. La concentración máxima de amoniaco en agua (una solución saturada) tiene una densidad de 0,880 g / cm 3 y, a menudo se conoce como 'amoniaco 0,880'. El amoníaco no se quema fácilmente o mantener combustión, excepto bajo estrechas mezclas de combustible-aire de 15 a 25% de aire.
- Combustión
- Cuando se mezcla con oxígeno , se quema con una llama de color verde amarillento pálido. A alta temperatura y en presencia de un catalizador adecuado, amoniaco se descompone en sus elementos constitutivos. Ignición se produce cuando el cloro se pasa en amoníaco, formando nitrógeno y cloruro de hidrógeno; si el cloro está presente en exceso, entonces el muy explosivo También se forma tricloruro de nitrógeno (NCl 3).
Estructura
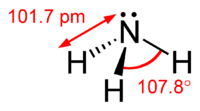
La molécula de amoníaco tiene una forma piramidal trigonal con un ángulo de enlace de 107.8 °, según lo predicho por la valencia de electrones shell teoría repulsión de los pares (TREPEV). El átomo de nitrógeno central tiene cinco electrones exteriores con un electrón adicional de cada átomo de hidrógeno. Esto da un total de ocho electrones, o cuatro pares de electrones que se disponen en tetraedros. Tres de estos pares de electrones se utilizan como pares de bonos, lo que deja un par de electrones. El par solitario de electrones se repelen con más fuerza que pares de bonos, por lo tanto el ángulo de enlace no es 109,5 °, como se esperaba para una disposición tetraédrica regular, pero se mide a 107,8 °. El átomo de nitrógeno en la molécula tiene una par de electrones solitario, lo que hace un amoníaco base, un aceptor de protones. Esta forma da la molécula de una momento dipolar y la hace polar. La polaridad de la molécula y, sobre todo, su capacidad para formar enlaces de hidrógeno, amoniaco hace altamente miscible con agua . El amoníaco es moderadamente básica, una solución acuosa 1,0 M tiene un pH de 11,6 y si un ácido fuerte se añade a una solución de este tipo hasta que la solución es neutro (pH = 7), 99,4% de las moléculas de amoníaco son protonada. La temperatura y la salinidad también afecta a la proporción de NH 4 +. Este último tiene la forma de un habitual tetraedro y es isoelectrónico con el metano . Se sabe que tienen la más alta capacidad calorífica específica de cualquier sustancia.
La molécula de amoniaco experimenta fácilmente inversión de nitrógeno a temperatura ambiente; una analogía útil es un paraguas girando del revés en un fuerte viento. La barrera de energía a esta inversión es 24,7 kJ / mol, y el frecuencia de resonancia es 23,79 GHz, correspondiente a la radiación de microondas de una longitud de onda de 1,260 cm. La absorción a esta frecuencia fue la primera espectro de microondas para observar.
Basicidad
Una de las propiedades más características de amoniaco es su basicidad. Se combina con ácidos para formar sales ; así con ácido clorhídrico forma cloruro de amonio (sal amoniaco); con ácido nítrico , nitrato de amonio, etc. Sin embargo, el amoníaco perfectamente seco se lo combine con perfectamente seco cloruro de hidrógeno; la humedad es necesario para llevar a cabo la reacción. Como experimento de demostración, abrió botellas de amoniaco concentrado y clorhídrico nubes producen ácido de cloruro de amonio, que se parecen aparecer "de la nada", como las formas de sal donde las dos nubes de difusión de moléculas se encuentran, en algún lugar entre las dos botellas.
- NH 3 + HCl → NH4Cl
Las sales producidas por la acción de amoniaco en los ácidos son conocidos como el sales de amonio y todos contienen la ion amonio (NH 4 +). Diluir amoniaco acuoso se puede aplicar sobre la piel para disminuir los efectos de los venenos de animales ácidas, tales como los insectos y medusas.
La basicidad del amoníaco también es la base de su toxicidad y su uso como un limpiador .
- Mediante la creación de una solución con un pH mucho mayor que una solución de agua neutral, proteínas ( enzimas) se desnaturalizar, lo que lleva a un daño celular, la muerte de la célula, y eventualmente la muerte del organismo.
- La suciedad a menudo consiste en grasas y aceites, que son poco solubles en agua. El amoníaco les pone en solución acuosa. El agua restante, que contiene también el exceso de amoníaco, se evapora por completo, dejando una superficie limpia.
Acidez
Aunque el amoníaco es bien conocido como una base débil, sino que también puede actuar como un ácido muy débil. Es una sustancia prótico y es capaz de formación de amidas (que contienen el NH 2 - ion). Por ejemplo, el litio se disuelve en amoniaco líquido para dar una solución de amida de litio:
- 2 Li + 2 NH 3 → 2 LiNH 2 + H 2
Auto-disociación
Como el agua, el amoníaco se somete autoionisation molecular para formar sus conjugados de ácidos y bases:
- 2 NH 3 (aq)
 NH +
NH +
4 (aq) + NH -
2 (aq)
A la presión y temperatura estándar, K = [NH +
4] [NH -
2] = 10 -30
Combustión
La combustión de amoníaco a nitrógeno y agua es exotérmica:
- 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 O (g) ( Δ H º r = -1267,20 kJ / mol)
La cambio de entalpía estándar de combustión, Δ H º c, expresada por mol de amoníaco y con la condensación del agua formada, es -382,81 kJ / mol. Dinitrógeno es el producto termodinámico de combustión: todos óxidos de nitrógeno son inestables con respecto al nitrógeno y oxígeno , que es el principio detrás de la conversor catalítico. Sin embargo, los óxidos de nitrógeno pueden formarse como productos cinéticos en presencia de catalizadores apropiados, una reacción de gran importancia industrial en la producción de ácido nítrico :
- 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
Una reacción posterior conduce a agua y NO 2
- 2 NO + O 2 → 2 NO2
La combustión de amoníaco en el aire es muy difícil en ausencia de un catalizador (tal como platino gasa), ya que la temperatura de la llama es generalmente más bajo que la temperatura de ignición de la mezcla de amoníaco al aire. El rango de inflamabilidad de amoníaco en el aire es de 16-25%.
La formación de otros compuestos
En química orgánica , el amoníaco puede actuar como una nucleófilo en sustitución de reacciones. Las aminas pueden ser formados por la reacción de amoniaco con haluros de alquilo, aunque el grupo -NH 2 resultante es también nucleófilo y aminas secundarias y terciarias a menudo se forman como subproductos. Un exceso de amoniaco ayuda a minimizar la sustitución múltiple, y neutraliza la haluro de hidrógeno formado. La metilamina se prepara comercialmente mediante la reacción de amoniaco con clorometano, y la reacción del amoníaco con el ácido 2-bromopropanoico se ha utilizado para preparar racémica alanina con un rendimiento del 70%. Etanolamina se prepara por una reacción de apertura de anillo con óxido de etileno: la reacción a veces se le permitió ir más allá de producir dietanolamina y trietanolamina.
Las amidas se pueden preparar mediante la reacción de amoniaco con un número de ácidos carboxílicos derivados. Cloruros de acilo son los más reactivos, pero el amoniaco deben estar presentes en al menos un exceso doble para neutralizar el cloruro de hidrógeno formado. Los ésteres y anhídridos también reaccionan con amoníaco para formar amidas. Sales de amonio de ácidos carboxílicos pueden ser deshidratado en amidas tanto tiempo ya que no hay térmicamente grupos sensibles presentes: temperaturas de 150-200 ° C se requieren.
El hidrógeno en amoniaco es capaz de sustitución por metales , por lo tanto, magnesio quemaduras en el gas con la formación de nitruro de magnesio Mg 3 N 2, y cuando el gas se pasa sobre climatizada de sodio o de potasio , sodamida, NaNH2 y potassamide, KNH 2, se forman. Cuando sea necesario en la nomenclatura sustitutiva , Recomendaciones de la IUPAC prefieren el nombre "azane" a amoníaco: por lo tanto, cloramina se llamaría "chloroazane" en la nomenclatura sustitutiva, no "chloroammonia".
Amoniaco pentavalente se conoce como λ 5 -amina, o más comúnmente, hidruro de amonio. Este sólido cristalino sólo es estable a alta presión, y se descompone de nuevo en amoniaco trivalente y gas hidrógeno en condiciones normales. Esta sustancia una vez fue investigado como posible combustible sólido de cohetes en 1966.
El amoníaco como un ligando
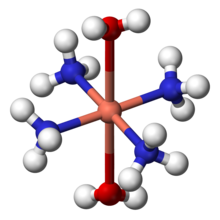
El amoníaco puede actuar como una ligando en metal de transición complejos. Es un σ-donante pura, en el medio de la serie espectroquímico, y muestra intermedia comportamiento duro-blando. Por razones históricas, el amoníaco se llama de amina en la nomenclatura de compuestos de coordinación. Algunos complejos de amina notables incluyen tetraamminediaquacopper (II) ([Cu (NH 3) 4 (H 2 O) 2] 2+), un complejo de color azul oscuro formado por la adición de amoníaco a la solución de cobre (II) sales. Es conocido como Reactivo de Schweizer. Diamminesilver (I) ([Ag (NH 3) 2] +) es la especie activa en Reactivo de Tollens. La formación de este complejo también puede ayudar a distinguir entre los precipitados de las diferentes haluros de plata: cloruro de plata (AgCl) es soluble en solución diluida (2 M) de amoniaco, bromuro de plata (AgBr) sólo es soluble en una solución concentrada de amoníaco, mientras que yoduro de plata (AgI) es insoluble en amoníaco acuoso.
Complejos de amina de cromo (III) se conocen en el siglo 19, y formaron la base de Teoría revolucionaria de Alfred Werner en la estructura de los compuestos de coordinación. Werner señalar sólo dos isómeros (FAC - y MER -) del complejo [CrCl 3 (NH 3) 3] se podría formar, y concluyó los ligandos deben ser dispuestos alrededor del ion metálico en el vértices de un octaedro . Esta propuesta ya ha sido confirmada por Cristalografía de rayos X.
Un ligando de amina unido a un ion metálico es marcadamente más ácido que una molécula de amoníaco libre, aunque desprotonación en solución acuosa es todavía escasa. Un ejemplo es el Reacción de calomelanos, donde el compuesto amidomercury resultante (II) es altamente insoluble.
- Hg 2 Cl 2 + 2 NH3 → Hg + HgCl (NH 2) + NH4 + + Cl -
Detección y determinación
Sales de amonio y de amonio se pueden detectar fácilmente, en rastros muy minutos, por la adición de La solución de Nessler, lo que da una coloración amarilla clara en presencia de la menor traza de sales de amonio o de amonio. Palos de azufre son quemados para detectar pequeñas fugas en los sistemas de refrigeración de amoníaco industrial. Cantidades más grandes pueden ser detectados por el calentamiento de las sales con un álcali cáustico o con cal viva, cuando el olor característico de amoniaco será a la vez evidente. La cantidad de amoníaco en sales de amonio se puede estimar cuantitativamente por destilación de las sales con sodio o hidróxido de potasio, el amoniaco evolucionado siendo absorbido en un volumen conocido de la norma de ácido sulfúrico y el exceso de ácido determina entonces volumétricamente; o el amoniaco puede ser absorbido en el ácido clorhídrico y el cloruro de amonio así formado precipita como hexacloroplatinato amonio, (NH4) 2 PtCl 6.
Nitrógeno amoniacal (NH3-N)
Nitrógeno amoniacal (NH3-N) es una medida comúnmente usada para probar la cantidad de Los iones de amonio, derivadas de forma natural a partir de amoníaco, y volvieron a amoníaco a través de procesos orgánicos, en agua o líquidos de desecho. Se trata de una medida que se utiliza principalmente para la cuantificación de los valores en el tratamiento de residuos y sistemas de purificación de agua, así como una medida de la salud de las reservas de agua naturales y hechas por el hombre. Se mide en unidades de mg / L ( miligramo por litros).
Historia

Los romanos llamaron a los depósitos de cloruro de amonio que recogieron desde cerca del templo de Amón ( griego Ἄμμων Amón) en antigua Libia ammoniacus sal '(sal de Amón) debido a la proximidad al templo cercano. Las sales de amonio se han conocido desde tiempos muy antiguos; de ahí el término Hammoniacus sal aparece en los escritos de Plinio, aunque no se sabe si el término es idéntico con el más moderno sal amoniaco ( cloruro de amonio).
En la forma de sal amoniaco (NÜSHADIR) amoníaco era importante para la Alquimistas musulmanes ya en el siglo octavo, menciona por primera vez por el químico Pérsico Ibn Hayyān, y para los europeos alquimistas desde el siglo 13, siendo mencionado por Alberto Magno. También fue utilizado por tintoreros de las Edad Media en forma de fermentado orina para alterar el color de los tintes vegetales. En el siglo 15, Basilius Valentinus mostró que el amoníaco se podría obtener por la acción de los álcalis en sal amoniaco. En un período posterior, cuando sal amoniaco se obtuvo mediante la destilación de las pezuñas y cuernos de los bueyes y neutralizar el carbonato resultante con ácido clorhídrico , el nombre de "espíritu de cuerno de ciervo" se aplicó a amoníaco.
El amoníaco gaseoso se aisló por primera Joseph Priestley en 1774 y se denominó por él "aire alcalina". Once años después, en 1785, Claude Louis Berthollet determinar su composición.
La Proceso de Haber-Bosch para producir amoniaco a partir del nitrógeno en el aire fue desarrollado por Fritz Haber y Carl Bosch en 1909 y patentado en 1910. Fue utilizado por primera vez a escala industrial por los alemanes durante la Primera Guerra Mundial , tras el bloqueo aliado que cortó el suministro de nitratos de Chile . El amoníaco se utiliza para producir explosivos para sostener su esfuerzo de guerra.
Antes de la disponibilidad de gas natural barato, el hidrógeno como un precursor de la producción de amoniaco fue producido a través de la electrólisis de agua o usando el proceso de cloro-álcali.
Usos
Fertilizante
Aproximadamente el 83% (a partir de 2004), de amoníaco se utiliza como fertilizantes ya sea como sus sales, soluciones o anhydrously. Cuando se aplica al suelo, ayuda a proporcionar mayores rendimientos de los cultivos, como el maíz y el trigo. 30% de nitrógeno agrícola aplicado en los EE.UU. es en forma de amoniaco anhidro y todo el mundo se aplican 110m de toneladas cada año.
Precursor de compuestos nitrogenados
El amoníaco es directa o indirectamente el precursor de la mayoría de los compuestos que contienen nitrógeno. Prácticamente todos los compuestos nitrogenados sintéticos se derivan de amoníaco. Un derivado importante es el ácido nítrico . Este material de claves se genera a través de la Proceso Ostwald por la oxidación de amoniaco con aire sobre un platino catalizador a 700-850 ° C, ~ 9 atm. El óxido nítrico es un intermedio en esta conversión:
- NH 3 + 2 O 2 → HNO 3 + H 2 O
El ácido nítrico se utiliza para la producción de fertilizantes , explosivos, y muchos compuestos orgánicos nitrogenados.
Limpiador
El amoníaco casero es una solución de NH3 en agua (es decir, hidróxido de amonio) que se utiliza como un limpiador de uso general para muchas superficies. Dado que los resultados de amoniaco en un brillo relativamente racha libre, uno de sus usos más comunes es para limpiar el vidrio, porcelana y acero inoxidable. También se utiliza con frecuencia para la limpieza de hornos y absorbiendo elementos para aflojar al horno-en la suciedad. Amoníaco de uso doméstico varía en la concentración en peso del 5 al 10% de amoníaco.
Fermentación
Las soluciones de amoniaco que van desde 16% a 25% se utilizan en el industria de la fermentación como fuente de nitrógeno para los microorganismos y para ajustar el pH durante la fermentación.
Agente antimicrobiano para productos alimenticios
Ya en 1895, se sabía que el amoniaco estaba "fuertemente antiséptico ... requiere 1,4 gramos por litro de preservar caldo de carne. "El amoniaco anhidro se ha demostrado eficaz como agente antimicrobiano para la alimentación animal y se utiliza comercialmente en la actualidad para reducir o eliminar la contaminación microbiana de la carne de vacuno . El New York Times informó en octubre de 2009 en una empresa estadounidense, Beef Products Inc., que resulta graso recortes de carne, con un promedio entre 50 y 70 por ciento de grasa, en siete millones de libras por semana de magra de res finamente texturizada ("baba rosa") mediante la eliminación de la grasa mediante calor y centrifugación, a continuación, la desinfección del producto magra con amoniaco; el proceso fue calificado por el Departamento de Agricultura como eficaz y seguro sobre la base de un estudio realizado en EE.UU. (financiado por vacuno) que encontró que el tratamiento reduce E. coli a niveles indetectables. La investigación adicional por el New York Times publicó en diciembre de 2009 puso de manifiesto las preocupaciones de seguridad sobre el proceso, así como las quejas de los consumidores sobre el sabor y el olor de la carne de vacuno tratada en los niveles óptimos de amoníaco. La semana siguiente, el periódico publicó un editorial, "Más peligros de la carne de tierra", reiterando las preocupaciones planteadas en el artículo de prensa. Varios días después, la editorial se adjuntó con una retracción, afirmando que había afirmado erróneamente había habido dos retiros del mercado de la carne de tierra debido a este proceso, y "No carne producida por Beef Products Inc. se ha relacionado con las enfermedades o brotes."
Los usos menores y emergentes
Refrigeración - R717
Debido a las propiedades de vaporización de amoníaco, que es un útil refrigerante. Era de uso antes de la popularización de clorofluorocarbonos (freones). El amoníaco anhidro es ampliamente utilizado en aplicaciones de refrigeración industrial y pistas de hockey debido a su alta la eficiencia energética y bajo costo. Sin embargo, adolece de las desventajas de toxicidad, que restringen su uso doméstico y de pequeña escala. Además de su uso en la moderna de refrigeración por compresión de vapor que se utiliza en una mezcla junto con hidrógeno y agua en frigoríficos de absorción. La Ciclo de Kalina, que es de creciente importancia para las plantas de energía geotérmica, depende de la amplia gama de ebullición de la mezcla de agua y amoníaco.
Como combustible


Se utilizó amoníaco durante la Segunda Guerra Mundial en los autobuses en Bélgica, y en aplicaciones de motores y de la energía solar antes de 1900. líquido amoniaco también alimentó la Reacción motor de cohete Motors XLR99, que alimentaba el X-15 aviones de investigación hipersónica. Aunque no es tan poderoso como otros combustibles, no dejaba hollín en el motor de cohete reutilizable y su densidad coincida aproximadamente con la densidad del oxidante, oxígeno líquido, que simplifica el diseño de la aeronave.
El amoníaco se ha propuesto como una alternativa práctica a los combustibles fósiles para motores de combustión interna. El poder calorífico del amoniaco es de 22,5 MJ / kg (9,690 BTU / lb), que es aproximadamente la mitad que la de diesel. En un motor normal, en la que no se condensa el vapor de agua, el valor calorífico de amoniaco será de aproximadamente 21% menos de esta cifra. Se puede utilizar en los motores existentes con solamente modificaciones menores a carburadores / inyectores.
Para satisfacer estas demandas, el capital significativo sería necesario aumentar los niveles actuales de producción. Aunque la segunda químico que más se produce, la escala de la producción de amoníaco es una pequeña fracción del consumo mundial de petróleo. Podría ser fabricado a partir de fuentes renovables de energía, así como el carbón o la energía nuclear. Es, sin embargo, significativamente menos eficaz que las baterías. La presa de 60 MW en Rjukan Telemark, Noruega produce amoniaco a través de la electrólisis del agua durante muchos años a partir de 1913 la producción de fertilizantes de gran parte de Europa. Si producido a partir de carbón, el CO 2 puede ser fácilmente secuestrado (los productos de la combustión son el nitrógeno y el agua). En 1981 una empresa canadiense convirtió un 1981 Chevrolet Impala de operar usando amoniaco como combustible.
Motores de amoníaco o motores de amoníaco, utilizando amoníaco como fluido de trabajo, se han propuesto y utilizado de vez en cuando. El principio es similar a la utilizada en una locomotora sin fuego, pero con amoníaco como fluido de trabajo, en lugar de vapor o aire comprimido. Motores de amoníaco se usan de manera experimental en el siglo 19 por Goldsworthy Gurney en el Reino Unido y en tranvías en Nueva Orleans.
Como estimulante

El amoníaco se ha encontrado un uso significativo en varios deportes - especialmente los deportes de fuerza de levantamiento de pesas y Levantamiento de pesas olímpico como estimulante respiratorio. El amoníaco se utiliza comúnmente en la fabricación ilegal de metanfetamina a través de una Reducción de Birch, el método de abedul de hacer metanfetamina es peligroso porque el metal alcalino y amoníaco líquido son a la vez extremadamente reactivo, y la temperatura del amoníaco líquido hace susceptible a ebullición explosiva cuando se añaden reactivos.
Textil
El amoníaco líquido se utiliza para el tratamiento de materiales de algodón, dan el inmueble como mercerización usando álcalis. En particular, se utiliza para el prelavado de la lana.
Gas de elevación
A temperatura y presión estándar, el amoníaco es menos densa que la atmósfera, y tiene aproximadamente 60% de la potencia de elevación de hidrógeno o helio. El amoníaco a veces se ha utilizado para llenar globos meteorológicos como una gas ascensional. Debido a su relativamente alto punto de ebullición (en comparación con el helio y el hidrógeno), amoníaco potencialmente podría ser refrigerado y licuado a bordo de una aeronave para reducir la elevación y añadir lastre (y regresó a un gas para añadir ascensor y reducir el lastre).
Tratamiento de la madera
El amoníaco se ha utilizado para oscurecer roble blanco quartersawn en Artísticos y de muebles de estilo misión. Vapores de amoníaco reacciona con los taninos naturales de la madera y hacen que el cambio de colores.
Precauciones de seguridad
Los EE.UU. Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido un límite de exposición de 15 minutos para el amoníaco gaseoso de 35 ppm en volumen en el aire del medio ambiente y un límite de exposición de 8 horas de 25 ppm en volumen. NIOSH ha reducido recientemente el IDLH 500-300 basado en recientes interpretaciones más conservadoras de investigaciones originales en 1943. IDLH (peligro inmediato para la vida y la salud) es el nivel al que un trabajador sano puede estar expuesto durante 30 minutos sin sufrir efectos irreversibles para la salud. Otras organizaciones tienen diferentes niveles de exposición. Normas de la Marina [US Bureau of Naves 1962] concentraciones máximas permitidas (MAC): La exposición prolongada (60 días): 25 ppm / 1 hora: 400 ppm Amoniaco vapor tiene un irritante olor penetrante,, picante, que actúa como una advertencia de potencialmente peligroso la exposición. El umbral de olor promedio es de 5 ppm, muy por debajo de cualquier peligro o daño. La exposición a altas concentraciones de amoníaco gaseoso puede causar daño pulmonar y la muerte. Aunque el amoníaco se encuentra regulado en los Estados Unidos como un gas no inflamable, todavía cumple la definición de un material que es tóxico por inhalación y requiere un permiso de seguridad peligroso para el transporte en cantidades superiores a 13 248 L (3500 galones).
Toxicidad
La toxicidad de las soluciones de amoniaco no suele causar problemas para los seres humanos y otros mamíferos, como existe un mecanismo específico para evitar su acumulación en el torrente sanguíneo. El amoníaco se convierte carbamoil fosfato por la enzima carbamoil fosfato sintetasa, y luego entra en el ciclo de la urea para ser incorporado, ya sea en aminoácidos o se excreta en la orina. Sin embargo, los peces y anfibios carecen de este mecanismo, ya que por lo general pueden eliminar el amoníaco de su cuerpo por excreción directa. El amoníaco incluso a concentraciones diluidas es altamente tóxico para los animales acuáticos, y por esta razón es clasificado como peligroso para el medio ambiente.
Información de almacenamiento
Similar a propano , amoníaco anhidro hierve por debajo de la temperatura ambiente. Un depósito de almacenamiento capaz de 250 psi es adecuado para contener el líquido. Compuestos de amonio nunca se debe permitir que entre en contacto con bases (a menos que en una reacción previsto y contenidos), cantidades peligrosas de gas amoníaco podría ser liberado.
El uso doméstico
Las soluciones de amoniaco (5-10% en peso) se utilizan como limpiadores para el hogar, en particular para vidrio. Estas soluciones son irritantes para los ojos y membranas mucosas (aparatos respiratorio y digestivo), y en menor medida la piel. Se debe tener cuidado de que el producto químico nunca se mezcla con cualquier líquido que contenga lejía o un gas venenoso puede dar. La mezcla con cloro productos -containing u oxidantes fuertes, como los hogares lejía, puede dar lugar a los compuestos peligrosos tales como cloraminas.
Uso de laboratorio de soluciones de amoniaco

Los peligros de soluciones de amoniaco dependen de la concentración: "diluir" soluciones de amoniaco son por lo general 5-10% en peso (<5,62 mol / L); Soluciones "concentrado" se preparan normalmente a> 25% en peso. Una solución al 25% (en peso) tiene una densidad de 0,907 g / cm 3, y una solución que tiene una densidad menor será más concentrada. La Clasificación de la Unión Europea de soluciones de amoniaco se da en la tabla.
| Concentración en peso (w / w) | Molaridad | Concentración masa / volumen (w / v) | Clasificación | Frases-R |
|---|---|---|---|---|
| 5-10% | 2,87 a 5,62 mol / L | 48,9 a 95,7 g / L | Irritante (Xi) | R36 / 37/38 |
| 10-25% | 5,62 a 13,29 mol / L | 95,7 a 226,3 g / L | Corrosivo (C) | R34 |
| > 25% | > 13,29 mol / L | > 226.3 g / L | Corrosivo (C) Peligroso para el medio ambiente (N) | R34, R50 |
- Frases S: (S1 / 2), S16, S36 / 37/39, S45, S61.
El vapor de amoníaco a partir de soluciones concentradas de amoníaco es muy irritantes para los ojos y el tracto respiratorio, y estas soluciones sólo debe ser manejado en una campana de humos. Soluciones saturadas ("0.880") pueden desarrollar una presión significativa dentro de una botella cerrada en un clima cálido, y la botella se debe abrir con cuidado; esto no suele ser un problema para 25% de soluciones ("0,900").
Las soluciones de amoniaco no deben mezclarse con los halógenos , como los productos tóxicos y / o explosivos se forman. El contacto prolongado de soluciones de amoniaco con plata , mercurio o sales de yoduro también pueden conducir a productos explosivos: tales mezclas se forman a menudo en análisis cualitativo inorgánico, y debe ser ligeramente acidificado pero sin concentrar (<6% w / v) antes de su eliminación una vez finalizada la prueba.
Uso Laboratorio de amoníaco anhidro (gas o líquido)
El amoníaco anhidro está clasificado como tóxico (T) y peligroso para el medio ambiente (N). El gas es inflamable ( temperatura de autoignición: 651 ° C) y puede formar mezclas explosivas con el aire (16-25%). La límite de exposición permisible (PEL) de los Estados Unidos es de 50 ppm (35 mg / m 3), mientras que el Concentración IDLH se estima en 300 ppm. La exposición repetida a amoniaco reduce la sensibilidad al olor del gas: normalmente el olor es detectable a concentraciones de menos de 50 ppm, pero los individuos desensibilizadas no puede detectar incluso a concentraciones de 100 ppm. El amoníaco anhidro corroe el cobre - y zinc -Con aleaciones, y por lo tanto accesorios de latón no se deben utilizar para la manipulación del gas. El amoníaco líquido también puede atacar de caucho y ciertos plásticos.
El amoníaco reacciona violentamente con los halógenos. Triyoduro de nitrógeno, una primario alto explosivo, se forma cuando el amoníaco entra en contacto con el yodo . El amoniaco hace que el explosivo polimerización de óxido de etileno. También forma explosiva fulminante compuestos con compuestos de oro , plata , mercurio , germanio o telurio , y con estibina. Reacciones violentas también se han reportado con acetaldehído, soluciones de hipoclorito, ferricianuro de potasio y peróxidos.
Síntesis y producción
Debido a sus muchos usos, el amoniaco es uno de los productos químicos inorgánicos más altamente producidos. Decenas de plantas químicas en todo el mundo producen amoniaco. El consumo de más del 1% de todo el poder por el hombre, la producción de amoníaco es un componente importante del presupuesto mundial de energía. Informes de investigación de mercado total de la producción de amoníaco en el 2012 es de 198 millones de toneladas y se prevé que aumentará en unos 35 millones de toneladas en 2019. China, produjo 28,4% de la producción mundial (cada vez más a partir del carbón como parte de la urea de síntesis), seguido de la India con el 8,6%, Rusia con 8,4%, y el de Estados Unidos , con un 8,2%. Alrededor del 80% o más del amoníaco producido se utiliza para la fertilización de cultivos agrícolas.
Antes del inicio de la Primera Guerra Mundial , la mayoría de amoniaco se obtuvo mediante la destilación seca de vegetales y desechos de animales productos nitrogenados, incluidos los camellos estiércol, donde se destila por la reducción de ácido nitroso y nitritos con hidrógeno; Además, fue producido por la destilación de carbón , y también por la descomposición de las sales de amonio por hidróxidos alcalinos tales como cal viva, la sal que se usa más en general, siendo el cloruro ( sal-amoniaco) así:
- 2 NH4Cl + 2 CaO → CaCl2+ Ca (OH)22 + NH3
El hidrógeno para la síntesis de amoníaco también podría ser producido económicamente mediante el uso de la reacción del gas de agua seguido por la reacción de desplazamiento de gas de agua, producido haciendo pasar vapor a través de rojo-caliente coque, para dar una mezcla de gases de hidrógeno y dióxido de carbono, seguido de la eliminación del carbono dióxido de "lavado" la mezcla de gas con agua a presión (25 atmósferas estándar (2,500 kPa)); o mediante el uso de otras fuentes como el carbón o coque de gasificación.
Las plantas modernas de producción de amoníaco-industrial dependen de la producción de hidrógeno para reaccionar con el nitrógeno atmosférico usando un magnetita catalizador o sobre un catalizador de Fe promovido a alta presión (100 atmósferas normales (10000 kPa)) y la temperatura (450 ° C) para formar amoníaco líquido anhidro. Este paso se conoce como el bucle de síntesis de amoniaco (también referido como el proceso de Haber-Bosch):
- 3 H2+ N2→ 2 NH3
El hidrógeno necesario para la síntesis de amoníaco también podría ser producido económicamente el uso de otras fuentes como el carbón o coque de gasificación o menos económicamente a partir de la electrólisis del agua en oxígeno + hidrógeno y otras alternativas que son actualmente poco práctico para gran escala. En un momento, la mayor parte de amoníaco de Europa se produjo a partir de la planta de Hydro en Vemork, a través de la ruta de la electrólisis. Diversas fuentes de electricidad de energía renovables también son potencialmente aplicables.
El amoníaco líquido como solvente
El amoníaco líquido es el solvente ionizante no acuoso más conocido y más estudiado. Su propiedad más notable es su capacidad para disolver metales alcalinos para formar soluciones altamente coloreados, eléctricamente conductoras que contienen electrones solvatados. Aparte de estas soluciones extraordinarias, gran parte de la química en amoníaco líquido se pueden clasificar por analogía con las reacciones relacionadas en soluciones acuosas. Comparación de las propiedades físicas de NH 3 con los de agua muestra NH 3 tiene el punto de fusión más bajo, punto de ebullición, la densidad, la viscosidad, la constante dieléctrica y conductividad eléctrica; esto es debido al menos en parte, a la unión más débil en H NH 3 y porque dicha unión no puede formar redes reticuladas, ya que cada NH 3 molécula sólo tiene un par solitario de electrones en comparación con los dos para cada H 2 O molécula. El auto iónica constante de disociación de NH líquido 3 a -50 ° C es de aproximadamente 10 -33 mol 2 · l -2 .
Solubilidad de sales
| Solubilidad (g de sal por cada 100 g de NH líquido3) | |
|---|---|
| Acetato de amonio | 253.2 |
| Nitrato de amonio | 389.6 |
| Nitrato de litio | 243.7 |
| Nitrato de sodio | 97.6 |
| Nitrato de potasio | 10.4 |
| El fluoruro de sodio | 0.35 |
| Cloruro de sodio | 157.0 |
| Bromuro de sodio | 138.0 |
| El yoduro de sodio | 161.9 |
| Tiocianato de sodio | 205.5 |
El amoníaco líquido es un disolvente ionizante, aunque en menor medida que el agua, y disuelve una gama de compuestos iónicos, incluyendo muchos nitratos , nitritos, cianuros y tiocianatos. La mayoría de las sales de amonio son solubles y actúan como ácidos en soluciones de amoníaco líquido. La solubilidad de las sales de haluro aumenta de fluoruro al yoduro. Una solución saturada de nitrato de amonio contiene 0,83 moles de soluto por mol de amoniaco y tiene una presión de vapor de menos de 1 bar, incluso a 25 ° C (77 ° F) .
Soluciones de metales
El amoníaco líquido se disolverá los metales alcalinos y otros metales electropositivos, tales como magnesio , calcio , estroncio , bario , europio y de iterbio . A bajas concentraciones (<0,06 mol / l), se forman soluciones de azul profundo: estos contienen cationes metálicos y electrones solvatados, los electrones libres que están rodeados por una jaula de moléculas de amoníaco.
Estas soluciones son muy útiles como agentes reductores fuertes. A concentraciones más elevadas, las soluciones son metálicos en apariencia y en la conductividad eléctrica. A bajas temperaturas, los dos tipos de solución pueden coexistir como fases inmiscibles.
Propiedades redox de amoníaco líquido
| E° (V, amoníaco) | E° (V, agua) | |
|---|---|---|
| Li++ e- ⇌Li | -2.24 | -3.04 |
| K++ e- ⇌K | -1.98 | -2.93 |
| Na++ e- ⇌Na | -1.85 | -2.71 |
| Zn2++ 2e- ⇌Zn | -0.53 | -0.76 |
| NH4 ++ e- ⇌½ H2+ NH3 | 0.00 | - |
| Cu2++ 2e- ⇌Cu | 0.43 | 0.34 |
| Ag++ e- ⇌Ag | 0.83 | 0.80 |
La gama de estabilidad termodinámica de soluciones de amoníaco líquido es muy estrecho, como el potencial de oxidación para dinitrógeno, E ° (N 2 + 6NH 4 + + 6e - ⇌ 8NH 3 ), sólo es 0,04 V. En la práctica, tanto la oxidación de dinitrógeno y la reducción de dihidrógeno son lentos. Esto es particularmente cierto de reducir soluciones: las soluciones de los metales alcalinos mencionados anteriormente son estables durante varios días, descomponiendo lentamente a la amida de metal y dihidrógeno. La mayoría de los estudios con soluciones de amoníaco líquido se realizan en condiciones reductoras; Aunque la oxidación de amoníaco líquido es por lo general lento, todavía hay un riesgo de explosión, en particular si los iones de metales de transición están presentes como posibles catalizadores.
El papel de amoniaco en los sistemas biológicos y las enfermedades humanas
El amoníaco es una fuente importante de nitrógeno para los sistemas vivos. Aunque el nitrógeno atmosférico abunda (más de 75%), unos seres vivos son capaces de utilizar este nitrógeno. Se requiere de nitrógeno para la síntesis de aminoácidos, que son los bloques de construcción de proteínas . Algunas plantas dependen de amoniaco y otros desechos nitrogenados incorporados en el suelo por la materia en descomposición. Otros, como fijadoras de nitrógeno legumbres, se benefician de las relaciones simbióticas con rizobios que crean amoníaco del nitrógeno atmosférico.
Biosíntesis
En ciertos organismos, el amoníaco se produce a partir de nitrógeno atmosférico por enzimas llamadas nitrogenasas. El proceso global se llama fijación de nitrógeno . Aunque es poco probable que los métodos biomiméticos que sean competitivos con el se desarrollarán proceso de Haber, intenso esfuerzo se ha dirigido hacia la comprensión del mecanismo de la fijación biológica de nitrógeno. El interés científico en este problema está motivada por la inusual estructura del sitio activo de la enzima, que consta de una Fe 7 MoS 9 conjunto.
El amoniaco es también un producto metabólico de aminoácido desaminación catalizada por enzimas tales como glutamato deshidrogenasa 1. El amoníaco excreción es común en los animales acuáticos. En los seres humanos, se convierte rápidamente a urea , que es mucho menos tóxico, particularmente menos básico . Esta urea es un componente importante del peso seco de la orina. La mayoría de los reptiles, aves, insectos y caracoles excretan ácido úrico únicamente como desechos nitrogenados.
En la fisiología
El amoníaco también juega un papel tanto en animal normal y anormal fisiología. Se biosintetizado a través del metabolismo de aminoácidos normal y es tóxico en altas concentraciones. La hígado convierte el amoníaco en urea a través de una serie de reacciones conocidas como la ciclo de la urea. disfunción del hígado, tales como la observada en la cirrosis, puede conducir a cantidades elevadas de amoníaco en la sangre ( hiperamonemia ). Del mismo modo, los defectos en las enzimas responsables de ciclo de la urea, tales como ornitina transcarbamilasa, conducen a hiperamonemia. Hiperamonemia contribuye a la confusión y coma de la encefalopatía hepática, así como la enfermedad neurológica común en personas con defectos del ciclo de la urea y acidurias orgánicos.
El amoníaco es importante para el equilibrio ácido animales / base normal. Después de la formación de amonio de glutamina, α-cetoglutarato puede ser degradado para producir dos moléculas de bicarbonato, que son entonces disponible como amortiguadores para los ácidos dietéticos. Amonio se excreta en la orina, lo que resulta en la pérdida neta de ácido. El amoníaco puede en sí difundirse a través de los túbulos renales, combinar con un ión de hidrógeno, y por lo tanto permitir una mayor excreción de ácido.
Excreción
Los iones de amonio son un producto de desecho tóxico del metabolismo en animales . En los peces e invertebrados acuáticos, que se excreta directamente en el agua. En los mamíferos, tiburones, y anfibios, se convierte en el ciclo de la urea a urea , debido a que es menos tóxico y se puede almacenar de manera más eficiente. En las aves, reptiles, y los caracoles terrestres, amonio metabólica se convierte en ácido úrico, que es sólido, y por lo tanto puede ser excretado con una pérdida mínima de agua.
En astronomía
El amoníaco se ha detectado en las atmósferas de los gigantes gaseosos planetas, incluyendo Júpiter , junto con otros gases como el metano, hidrógeno y helio . El interior de Saturno puede incluir cristales congelados de amoníaco. Se encuentra naturalmente en Deimos y Fobos - las dos lunas de Marte.
El espacio interestelar
El amoníaco se detectó por primera vez en el espacio interestelar en 1968, basado en las emisiones de microondas desde la dirección del centro galáctico . Esta fue la primera molécula poliatómico que ser tan detectado. La sensibilidad de la molécula a una amplia gama de excitaciones y la facilidad con la que se puede observar en un número de regiones ha hecho amoníaco una de las moléculas más importantes para los estudios de nubes moleculares. La intensidad relativa de las líneas de amoníaco se puede utilizar para medir la temperatura del medio emisor de luz.
La siguiente especie isotópica de amoniaco se han detectado:
- NH3,15NH3, NH2 D, NHD2, y ND3
La detección de triplemente amoniaco deuterado fue considerado una sorpresa ya que el deuterio es relativamente escasa. Se cree que las condiciones de baja temperatura permiten esta molécula para sobrevivir y se acumulan.
Desde su descubrimiento interestelar, NH 3 ha demostrado ser una herramienta muy valiosa espectroscópica en el estudio del medio interestelar. Con un gran número de transiciones sensibles a una amplia gama de condiciones de excitación, NH 3 ha sido ampliamente astronómicamente detectado - su detección ha sido reportado en cientos de artículos de revistas. A continuación se ofrece una muestra de artículos de revistas que destaca la gama de detectores que se han utilizado para identificar el amoníaco.
El estudio de amoníaco interestelar ha sido importante para una serie de áreas de investigación en las últimas décadas. Algunos de estos son delineados a continuación e involucran principalmente usando amoniaco como un termómetro interestelar.
Mecanismos de formación de Interstellar
La abundancia interestelar para el amoníaco se ha medido para una variedad de entornos. El [NH 3 ] / [H 2 relación] se ha estimado en un rango de 10 -7 en pequeñas nubes oscuras hasta 10 -5 en el núcleo denso de la compleja nube molecular de Orión. Aunque se han propuesto un total de 18 totales rutas de producción, el mecanismo de formación principal para interestelar NH 3 es la reacción:
- NH4 ++ e-→ NH3+ H ·
La constante de velocidad, k , de esta reacción depende de la temperatura del medio ambiente, con un valor de 5,2 × 10 -6 a 10 K. La constante de velocidad se calcula a partir de la fórmula k = a (T / 300) B . Para la reacción de formación primariun, a = 1,05 × 10 -6 y B = -0,47. Suponiendo un NH 4 + abundancia de 3 × 10 -7 y una abundancia de electrones de 10 -7 típico de nubes moleculares, la formación procederá a una velocidad de 1,6 × 10 -9 cm -3 s -1 en una nube molecular del total de densidad de 10 5 cm -3 .
Todas las otras reacciones de formación propuestos tienen constantes de velocidad de entre 2 y 13 órdenes de magnitud más pequeña, por lo que su contribución a la abundancia de amoniaco relativamente insignificante. Como un ejemplo de la menor contribución reacciones otra formación desempeñan, la reacción:
- H2+ NH2→ NH3+ H
tiene una constante de velocidad de 2,2 × 10 -15 . Suponiendo H 2 densidades de 10 5 y NH 2 / H 2 proporción de 10 -7 , esta reacción tiene lugar a una velocidad de 2,2 × 10 -12 , más de 3 órdenes de magnitud más lentas que la reacción primaria anteriormente.
Algunas de las otras reacciones posibles de formación son:
- H-+ NH4 +→ NH3+ H2
- PNH3 ++ e-→ P + NH3
Mecanismos de destrucción de Interstellar
Hay 113 totales reacciones propuestas que conducen a la destrucción de NH 3 . De éstos, 39 fueron tabulados en extensas tablas de la química entre los compuestos C, N y O. Una revisión de amoniaco interestelar cita las siguientes reacciones como los principales mecanismos de disociación:
- (1) NH3+ H3 +→ NH4 ++ H2
- (2) NH3+ HCO+→ NH4 ++ CO
con constantes de velocidad de 4,39 × 10 -9 × 10 y 2,2 -9 , respectivamente. Las ecuaciones anteriores (1,2) se ejecutan a una velocidad de 8,8 × 10 -9 × 10 y 4,4 -13 , respectivamente. Estos cálculos asumen las constantes y abundancias de [NH tasa dados 3 ] / [H 2 ] = 10 -5 , [H 3 + ] / [H 2 ] = 2 × 10 -5 , [HCO + ] / [H 2 ] = 2 × 10 -9 , y las densidades totales de n = 10 5 , típico de frías y densas nubes moleculares. Evidentemente, entre estas dos reacciones primarias, la ecuación (1) es la reacción de destrucción dominante, con una tasa de ~ 10.000 veces más rápido que la ecuación (2). Esto es debido a la relativamente alta abundancia de H 3 + .
Detecciones de antenas individuales
Las observaciones de radio de NH 3 desde el Telescopio de radio Effelsberg de 100 m revelan que la línea de amoniaco se separa en dos componentes - un canto de fondo y un núcleo sin resolver. El fondo se corresponde bien con las ubicaciones previamente detectados CO. El 25 m Telescopio Chilbolton en Inglaterra detectado firmas de radio de amoníaco en las regiones H II , HNH 2 O máser, objetos HH y otros objetos asociados con la formación estelar. Una comparación de los anchos de línea de emisión indica que las velocidades turbulentas o sistemáticas no aumentan en los núcleos centrales de las nubes moleculares.
La radiación de microondas a partir de amoníaco se observó en varios objetos galácticos incluyendo W3 (OH), Orion A, W43, W51, y cinco fuentes en el centro de la galaxia. La tasa de detección de alto indica que se trata de una molécula común en el medio interestelar y que las regiones de alta densidad son comunes en la galaxia.
Estudios interferométricos
Observaciones del VLA de NH 3 en siete regiones con alta velocidad las salidas de gases revelaron condensaciones de menos de 0.1 pc en L1551, S140, y se detectaron Cefeo A. Tres condensaciones individuales en Cefeo A, uno de ellos con una forma muy alargada. Ellos pueden desempeñar un papel importante en la creación de la salida bipolar en la región.
Amoniaco extragaláctica fue fotografiada usando el VLA en IC 342. El gas caliente tiene temperaturas superiores a 70 K, que se deduce de las proporciones de la línea de amoníaco y parece estar estrechamente asociada a las partes más internas de la barra nuclear se ve en CO. NH 3 también fue supervisado por VLA hacia una muestra de cuatro ultracompacto galáctica HII regiones: G9.62 + 0,19, G10.47 + 0.03, G29.96-0.02 y G31.41 + 0.31. Basándose en los diagnósticos de temperatura y densidad, se concluye que, en general, tales grupos es probable que sean los sitios de formación de estrella masiva en una fase evolutiva temprana antes del desarrollo de una región ultracompacto HII.
Detecciones infrarrojos
Absorción a 2,97 micrómetros debido a amoniaco sólido se registró a partir de granos interestelares en el objeto Becklin-Neugebauer y probablemente en NGC 2264-IR también. Esta detección ayudó a explicar la forma física de las líneas de absorción de hielo previamente poco conocidos y relacionados.
Un espectro del disco de Júpiter se obtuvo de la Airborne Observatorio Kuiper, que cubre el 100 a 300 cm -1 rango espectral. Análisis del espectro proporciona información sobre las propiedades medias globales de gas de amoniaco y una bruma amoniaco hielo.
Un total de 149 puestos de nubes oscuras fueron encuestados para la evidencia de 'núcleos densos' mediante el uso de la (J, K) = (1,1) que gira línea de inversión de NH 3 . En general, los núcleos no tienen forma esférica, con relaciones de aspecto que van desde 1,1 hasta 4,4. También se encontró que los núcleos con estrellas tienen líneas más amplias que los núcleos sin estrellas.
El amoníaco se ha detectado en la nebulosa de Draco y en uno o posiblemente dos nubes moleculares, que están asociados con la alta latitud galáctica cirrus infrarrojo. El hallazgo es significativo, ya que pueden representar los lugares de nacimiento de las estrellas de Población I metalicidad de tipo B en el halo galáctico que podría haber sido transmitidas en el disco galáctico.
Las observaciones de nubes oscuras cercana
Al equilibrar y emisión estimulada con la emisión espontánea, es posible construir una relación entre la temperatura y la densidad de excitación. Además, dado que los niveles de transición de amoníaco pueden ser aproximadas por un sistema de 2-nivel a bajas temperaturas, este cálculo es bastante simple. Esta premisa se puede aplicar a las nubes oscuras, regiones sospechosas de tener temperaturas extremadamente bajas y posibles sitios para la formación futura estrella. Detecciones de amoníaco en nubes oscuras muestran líneas-indicativos no sólo de las bajas temperaturas, sino también de un bajo nivel de turbulencia interna en la nube muy estrechos. Cálculos de la relación Line proporcionan una medición de la temperatura de nube que es independiente de CO observaciones anteriores. Las observaciones de amoníaco fueron consistentes con las mediciones de CO de temperaturas de rotación de ~ 10 K. Con esto, las densidades pueden ser determinados, y se han calculado a variar entre 10 4 y 10 5 cm -3 en nubes oscuras. Cartografía de NH 3 da nubes típicas tamaños de 0.1 pc y masas cerca de 1 masa solar. Estas frías, núcleos densos son los sitios de formación estelar futuro.
Regiones HII UC
Regiones ultra-compacto HII se encuentran entre los mejores marcadores de la formación de estrellas de gran masa. El material denso que rodea regiones Uchii es probable principalmente molecular. Desde un estudio completo de la formación estelar masiva implica necesariamente la nube de la que formó la estrella, el amoníaco es una herramienta invaluable para entender este material molecular circundante. Desde este material molecular puede ser resuelto espacialmente, es posible limitar el calentamiento / fuentes, temperaturas, masas y tamaños de las regiones ionizante. Componentes de la velocidad Doppler desplazada permiten la separación de distintas regiones de gas molecular que pueden trazar las salidas y núcleos calientes procedentes de las estrellas que forman.
Detección extragaláctica
El amoníaco se ha detectado en galaxias externas, y midiendo simultáneamente varias líneas, es posible medir directamente la temperatura del gas en estas galaxias. Relaciones de línea implican que las temperaturas del gas son cálidos (~ 50 K), originarios de las nubes densas con tamaños de decenas de pc. Este cuadro es consistente con la imagen dentro de nuestra Vía Láctea densa forma núcleos moleculares galaxia caliente alrededor de reciente formación estrellas incrustadas en las nubes más grandes de material molecular en la escala de varios cientos de pc (nubes moleculares gigantes; GMC).