
Tabla periódica
Antecedentes de las escuelas de Wikipedia
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
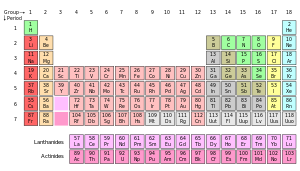
La tabla periódica es una exhibición tabular de los elementos químicos , organizada sobre la base de sus números atómicos , configuraciones de electrones, y recurrente propiedades químicas. Los elementos se presentan en orden creciente de número atómico (número de protones). La forma estándar de mesa comprende una cuadrícula de 18 × 7 o cuerpo principal de elementos, situado por encima de una doble fila de elementos más pequeños. La tabla también puede ser deconstruido en cuatro bloques rectangulares: el s-bloque a la izquierda, el p-bloque a la derecha, la d-bloque en el medio, y el f-bloque por debajo de eso. Las filas de la tabla se denominan períodos; las columnas de las S-, d-, y p-bloques se denominan grupos, con algunos de estos que tienen nombres tales como los halógenos o los gases nobles . Dado que, por definición, una tabla periódica incorpora tendencias recurrentes, cualquier tabla pueden utilizarse para deducir relaciones entre las propiedades de los elementos y predecir las propiedades de nuevo, todavía no se ha descubierto o sintetizado, elementos. Como resultado, una mesa, ya sea periódica en forma estándar o alguna otra variante, proporciona un marco útil para analizar comportamiento químico, y tales tablas son ampliamente utilizados en la química y otras ciencias.
Aunque existan los precursores, Dmitri Mendeleev se acredita generalmente con la publicación, en 1869, de la primera tabla periódica ampliamente reconocida. Desarrolló su tabla para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos. Mendeleev también predijo algunas propiedades de elementos entonces-desconocidos que se espera para llenar los vacíos en esta tabla. La mayoría de sus predicciones se demostró correcta cuando los elementos en cuestión fueron posteriormente descubrieron. Tabla periódica de Mendeleiev desde entonces se ha ampliado y perfeccionado con el descubrimiento o la síntesis de nuevos elementos nuevos y el desarrollo de nuevos modelos teóricos para explicar comportamiento químico.
Todos los elementos de números atómicos 1 ( hidrógeno ) a 118 ( ununoctium ) se han descubierto o sintetizado. De éstos, todos hasta e incluyendo el californio existen naturalmente; el resto sólo se han sintetizado en laboratorios. Está llevando a cabo la producción de elementos más allá ununoctium, con la cuestión de cómo puede necesitar la tabla periódica para ser modificado para adaptarse a cualquier tipo de adiciones siendo un tema de debate en curso. Numerosos sintética radionucleidos de los elementos presentes en la naturaleza también se han producido en los laboratorios.
Disposición
| Tabla periódica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||||||||||||||
| ↓ Período | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 H | 2 Él | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 3 Li | 4 Ser | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Nebraska | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 N / A | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Arkansas | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 K | 20 California | 21 Sc | 22 Ti |
23 V | 24 Cr | 25 Minnesota | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Georgia | 32 Ge | 33 Como | 34 Se |
35 Br | 36 Kr | ||||||||||||||||||||||||||||||||||||||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd |
47 Ag | 48 CD | 49 En | 50 Sn | 51 Sb | 52 Te | 53 YO | 54 Xe | ||||||||||||||||||||||||||||||||||||||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta |
74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Correos | 85 En | 86 Rn |
||||||||||||||||||||||||||||||||||||||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Mx | 107 Bh | 108 Hs | 109 Montana | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Florida | 115 Uup | 116 Lv | 117 Uus | 118 Uuo | ||||||||||||||||||||||||||||||||||||||
| * lantánidos | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Ue | 64 Di-s | 65 Tuberculosis | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |||||||||||||||||||||||||||||||||||||||||
| ** actínidos | 89 Corriente alterna | 90 Th | 91 Papá | 92 U | 93 Np | 94 Pu | 95 Soy | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Maryland | 102 No |
103 Lr | |||||||||||||||||||||||||||||||||||||||||
Esta es una disposición de la tabla periódica de 18 columna, que ha llegado a ser conocido como la forma común o estándar, a causa de su popularidad. También se refiere a veces como la forma larga, en comparación con la forma corta o Al estilo de Mendeleev, que omite los grupos 3-12 colocando sus elementos en los grupos principales. La tabla periódica amplia incorpora los lantánidos y los actínidos , más que los separa del cuerpo principal de la mesa con el fin de ahorrar espacio. La tabla periódica extendida añade los períodos octavo y noveno, incluido el superactinides. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Todas las versiones de la tabla periódica incluyen sólo elementos químicos, no mezclas, compuestos , o partículas subatómicas. Cada elemento químico tiene un número atómico único que representa el número de protones en su núcleo. La mayoría de los elementos tienen diferentes números de neutrones entre los diferentes átomos, con estas variantes se conocen como isótopos . Por ejemplo, el carbono tiene tres isótopos naturales: todos sus átomos tienen seis protones y la mayoría tienen seis neutrones también, pero alrededor del uno por ciento tiene siete neutrones, y una fracción muy pequeña tiene ocho neutrones. Isótopos nunca se separan en la tabla periódica; que siempre se agrupan en un solo elemento. Elementos sin isótopos estables tienen las masas atómicas de los isótopos más estables, donde se muestran estas masas, que figuran entre paréntesis.
En la tabla periódica estándar, los elementos se enumeran en orden creciente de número atómico (número de protones en el núcleo de un átomo). Una nueva fila ( período) se inició cuando una nueva capa de electrones tiene su primer electrón. Columnas ( grupos) están determinadas por la configuración electrónica del átomo; elementos con el mismo número de electrones en particular, una subcapa caen en las mismas columnas (por ejemplo, oxígeno y selenio están en la misma columna, ya que ambos tienen cuatro electrones en la más externa p-subcapa). Los elementos con propiedades químicas similares generalmente caen en el mismo grupo de la tabla periódica, aunque en la f-bloque, y hasta cierto respeto en el d-bloque, los elementos en el mismo período tienden a tener propiedades similares, también. Por lo tanto, es relativamente fácil de predecir las propiedades químicas de un elemento si uno sabe las propiedades de los elementos a su alrededor.
A partir de 2012, la tabla periódica contiene 118 elementos químicos confirmados. De estos elementos, 114 han sido reconocidos oficialmente y nombrado por el Unión Internacional de Química Pura y Aplicada (IUPAC). Un total de 98 de estos se produce de forma natural, de los cuales 84 son primordial. Los otros 14 elementos naturales sólo se producen en cadenas de desintegración de los elementos primordiales. Todos los elementos de einsteinium a copernicio , así como flerovium y livermorium, mientras que no ocurre naturalmente en el universo, han sido debidamente sintetizada y oficialmente reconocida por la IUPAC. Elementos 113 , 115 , 117 y 118 según los informes, se han sintetizado en laboratorios pero estos informes aún no han sido confirmados. Como tal estos elementos son actualmente conocidos sólo por sus nombres de elementos sistemáticos, basados en sus números atómicos. No elemento más pesado que einsteinium (elemento 99) nunca se ha observado en cantidades macroscópicas en su forma pura. No hay elementos últimos 118 se han sintetizado a partir de 2012.
Métodos de agrupación
Grupos
Un grupo o familia es una columna vertical en la tabla periódica. Los grupos normalmente tienen tendencias periódicas más significativos que los períodos y los bloques, se explican a continuación. Teorías mecánicas del quántum moderno de la estructura atómica explican las tendencias del grupo proponiendo que los elementos de un mismo grupo en general tienen las mismas configuraciones electrónicas en su capa de valencia. En consecuencia, los elementos del mismo grupo tienden a tener una química compartida y muestran una tendencia clara en las propiedades con el aumento de número atómico. Sin embargo, en algunas partes de la tabla periódica, como la d-bloque y la f-bloque, similitudes horizontales pueden ser tan importantes como, o más pronunciada que, similitudes verticales.
Bajo una convención de nomenclatura internacional, los grupos están numeradas numéricamente de 1 a 18 de la columna más a la izquierda (los metales alcalinos) a la columna más a la derecha (los gases nobles). Anteriormente, eran conocidos por los números romanos . En Estados Unidos, los números romanos fueron seguidas por una "A" si el grupo estaba en el s- o p-bloque, o una "B" si el grupo estaba en el d-bloque. Los números romanos usados corresponden a la última cifra del convenio de denominación de hoy (por ejemplo, la grupo 4 elementos estaban grupo IVB y la grupo 14 elementos fue grupo IVA). En Europa, las letras fue similar, excepto que "A" se utiliza si el grupo era antes grupo 10, y "B" se utilizó para los grupos incluidos y después de grupo 10. Además, los grupos 8, 9 y 10 se utilizan para ser tratado como un grupo de triple de tamaño, conocidos colectivamente en ambas notaciones como grupo VIII. En 1988, el nuevo sistema de nomenclatura IUPAC se puso en uso, y los nombres de los grupos de edad se ha desaprobado.
| Grupo | Nombre |
|---|---|
| 1 | metales alcalinos |
| 2 | metales de tierras alcalinas |
| 11 | metales de acuñación |
| 12 | metales volátiles (poco frecuente) |
| 13 | icosagens (poco frecuente) |
| 14 | crystallogens (poco frecuente) |
| 15 | pnictogens |
| 16 | calcógenos |
| 17 | halógenos |
| 18 | gases nobles (raramente aerogens ) |
Algunos de estos grupos se les ha dado nombres triviales (no sistemáticas), como se ve en la tabla de la derecha, aunque algunos raramente se utilizan. Grupos 10.3 no tienen nombres triviales y se denominan simplemente por sus números de grupo o por el nombre del primer miembro de su grupo (como "el grupo de escandio 'para Grupo 3), ya que presentan un menor número de similitudes y / o tendencias verticales.
Elementos en el mismo grupo tienden a mostrar patrones en radio atómico, energía de ionización, y electronegatividad. De arriba a abajo en un grupo, los radios atómicos de los elementos de aumentar. Puesto que hay niveles de energía más llenos, los electrones de valencia se encuentran más lejos del núcleo. Desde la parte superior, cada elemento sucesivo tiene una energía de ionización más bajo, ya que es más fácil de quitar un electrón desde los átomos están menos fuertemente unidas. Del mismo modo, un grupo tiene una parte superior de disminución inferior en electronegatividad debido a una distancia cada vez mayor entre los electrones de valencia y el núcleo. Hay excepciones a estas tendencias, sin embargo, un ejemplo de lo que ocurre en grupo 11 donde electronegatividad aumenta más abajo en el grupo.
Periodos
Un período es una fila horizontal en la tabla periódica. Aunque los grupos generalmente tienen tendencias periódicas más importantes, hay regiones donde las tendencias horizontales son más significativos que las tendencias de grupos verticales, como el f-bloque, donde los lantánidos y actínidos forman dos series horizontal sustancial de elementos.
Los elementos de las mismas tendencias período muestran en radio atómico, energía de ionización, afinidad electrónica y electronegatividad. Traslado de izquierda a derecha en un período, radio atómico por lo general disminuye. Esto ocurre porque cada elemento sucesivo tiene un protón añadido y de electrones que hace que el electrón que se puede extraer más cerca del núcleo. Esta disminución en el radio atómico también hace que la energía de ionización a aumentar cuando se mueve de izquierda a derecha en un período. Cuanto más fuertemente unido un elemento es, se requiere más energía para quitar un electrón. Electronegatividad aumenta de la misma manera como la energía de ionización, debido a la tracción ejercida sobre los electrones por el núcleo. Afinidad electrónica también muestra una ligera tendencia a través de un período. Metales (lado izquierdo de un período) tienen generalmente una afinidad electrónica más baja que los elementos no metálicos (lado derecho de un periodo), con la excepción de los gases nobles.
Bloques

Debido a la importancia de la capa electrónica más externa, las diferentes regiones de la tabla periódica se refieren a veces como bloques, nombrados de acuerdo a la subshell en el que reside la "última" de electrones. La s-bloque comprende los dos primeros grupos (metales alcalinos y de metales alcalinotérreos), así como el hidrógeno y el helio. La p-bloque comprende los últimos seis grupos que son grupos de 13 a 18 en IUPAC (3A a 8A en Americana) y contiene, entre otros elementos, la totalidad de la metaloides. La d-bloque comprende los grupos 3 a 12 en IUPAC (o 3B a 2B en la numeración grupo americano) y contiene todos los metales de transición. El bloque f, por lo general de desplazamiento por debajo del resto de la tabla periódica, comprende los lantánidos y actínidos.
Otros convenios y variaciones
En las presentaciones de la tabla periódica, los lantánidos y los actínidos se muestran habitualmente como dos filas adicionales por debajo del cuerpo principal de la tabla, con marcadores de posición o bien un solo elemento seleccionado de cada serie (ya sea lantano o lutecio, y, o bien actinio o lawrencium , respectivamente) se muestra en una única celda de la tabla principal, entre bario y hafnio , y el radio y rutherfordium , respectivamente. Esta convención es una cuestión de estética y practicidad formatear; un poco usado tabla periódica amplia con formato inserta el lantánidos y actínidos en sus lugares apropiados, como partes de sexta y séptima filas de la tabla (períodos).
 |  |
| Tabla periódica con f-bloque separado (izquierda) y en línea (a la derecha) | |
Algunas tablas periódicas incluyen un línea divisoria, o equivalente, entre los metales y no metales. Varios otros categorías de elementos también pueden ser resaltados en una tabla periódica incluyendo, por ejemplo, metales de transición , posterior a la transición metales, o metaloides. Agrupaciones especializadas, como el metales refractarios y la metales nobles, que son subconjuntos (en este ejemplo) de los metales de transición, también son conocidos y, ocasionalmente, denotados.
Tendencias periódicas
Configuración electrónica

La configuración electrónica u organización de los electrones que orbitan los átomos neutros muestra un patrón o periodicidad recurrente. Los electrones ocupan una serie de capas electrónicas (shell numerada 1, shell 2, y así sucesivamente). Cada carcasa se compone de uno o más subcapas (s nombradas, p, d, f y g). Como el número atómico aumenta, los electrones llenan progresivamente estas conchas y subniveles más o menos de acuerdo con la Regla de Madelung o regla de ordenación de la energía, como se muestra en el diagrama de la derecha. La configuración electrónica de neón , por ejemplo, es 1s 2 2s 2 2p 6. Con un número atómico de cada diez, el neón tiene dos electrones en la primera capa, y ocho electrones en la segunda capa y dos en el subnivel s y seis en el subnivel p. En términos tabla periódica, la primera vez que un electrón ocupa un nuevo shell corresponde al inicio de cada nuevo período, estas posiciones están ocupadas por hidrógeno y los metales alcalinos .

Dado que las propiedades de un elemento están determinadas principalmente por su configuración electrónica, las propiedades de los elementos también muestran patrones o comportamiento periódico, algunos ejemplos de los cuales se muestran en el diagrama de la izquierda recurrentes. Es esta periodicidad de las propiedades, las manifestaciones de los cuales fueron notado mucho antes de la se desarrolló la teoría subyacente , que llevó a la creación de la ley periódica (las propiedades de los elementos se repiten a intervalos variables) y la formulación de las primeras tablas periódicas.
Radios atómicos
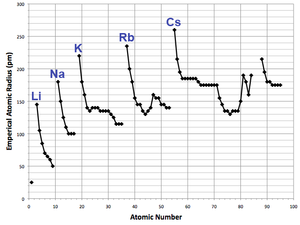
Radios atómicos varían de una manera predecible y explicable a través de la tabla periódica. Por ejemplo, los radios generalmente disminuyen a lo largo de cada período de la mesa, de los metales alcalinos a los gases nobles; y aumentar abajo de cada grupo. El radio aumenta bruscamente entre el gas noble al final de cada período y el metal alcalino en el comienzo del siguiente período. Estas tendencias de los radios atómicos (y de varias otras propiedades físicas de los elementos químicos y) puede ser explicado por la teoría capa de electrones del átomo; aportaron pruebas importantes para el desarrollo y la confirmación de la teoría cuántica .
Los electrones en el 4F-subcapa, que se llena progresivamente de cerio (Z = 58) para lutecio (Z = 71), no son particularmente eficaces en la protección de la carga nuclear aumento de las sub-cáscaras más lejos. Los elementos inmediatamente después de los lantánidos tienen radios atómicos que son más pequeñas de lo que se esperaba y que son casi idénticos a los radios atómicos de los elementos inmediatamente por encima de ellos. Por lo tanto hafnio tiene prácticamente el mismo radio atómico (y química) como circonio , y tantalio tiene un radio atómico similar a la de niobio , y así sucesivamente. Esto se conoce como la la contracción de los lantánidos. El efecto de la contracción de los lantánidos es notable hasta el platino (Z = 78), después de lo cual se enmascara por un efecto relativista conocido como el efecto par inerte. La contracción d-bloque, que es un efecto similar entre el d-bloque y p-bloque, es menos pronunciada que la contracción de los lantánidos sino que surge de una causa similar.
Energía de ionización

La primera energía de ionización es la energía que se necesita para quitar un electrón de un átomo, la segunda energía de ionización es la energía que se necesita para eliminar un segundo electrón del átomo, y así sucesivamente. Para un átomo dado, las energías de ionización sucesivas aumentan con el grado de ionización. Para magnesio como un ejemplo, la primera energía de ionización es 738 kJ / mol y la segunda es 1.450 kJ / mol. Los electrones en los orbitales más estrechos experimentan mayores fuerzas de atracción electrostática; por lo tanto, su eliminación requiere cada vez más energía. Energía de ionización se hace mayor hacia arriba y hacia la derecha de la tabla periódica.
Grandes saltos en las sucesivas energías de ionización molares se producen al extraer un electrón de una configuración de gas noble (capa de electrones completa). Para magnesio de nuevo, los dos primeros molares energías de ionización de magnesio dadas anteriormente corresponden a la eliminación de los dos electrones 3s, y la tercera energía de ionización es un mucho más grande 7.730 kJ / mol, para la eliminación de un electrón 2p de la muy estable de neón -como configuración de Mg 2 +. Saltos similares ocurren en las energías de ionización de otros átomos de la tercera fila.
Electronegatividad

Electronegatividad es la tendencia de un átomo para atraer electrones . Electronegatividad de un átomo es afectada tanto por su número atómico y la distancia entre el electrones de valencia y el núcleo. Cuanto mayor sea su electronegatividad, más un elemento atrae electrones. Se propuso por primera vez por Linus Pauling en 1932. En general, los aumentos de electronegatividad al pasar de izquierda a derecha a lo largo de un período, y disminuye al descender un grupo. Por lo tanto, el flúor es el más electronegativo de los elementos, mientras que el cesio es el menos importante, al menos de aquellos elementos sobre los que se dispone de datos contundentes.
Hay algunas excepciones a esta regla general. Galio y germanio tienen electronegatividades más altas que de aluminio y de silicio , respectivamente, debido a la contracción d-bloque. Elementos del cuarto período inmediatamente después de la primera fila de los metales de transición tienen inusualmente pequeña radios atómicos porque el 3d-electrones no son eficaces en el aumento de la carga de blindaje nuclear, y el tamaño atómico más pequeño se correlaciona con mayor electronegatividad. El anómalamente alta electronegatividad de plomo, en particular cuando se compara con talio y bismuto , parece ser un artefacto de selección de datos (y la disponibilidad de datos) -Métodos de cálculo que no sea el método de Pauling mostrar las tendencias periódicas normales para estos elementos.
Afinidad electronica
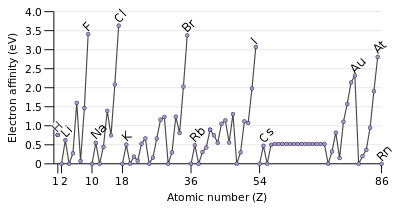
La afinidad de electrones de un átomo es la cantidad de energía liberada cuando se añade un electrón a un átomo neutro para formar un ion negativo. Aunque afinidad electrónica es muy variable, algunos patrones emergen. Generalmente, no metales tienen valores de afinidad electrónica más positivos que los metales . Cloro con más fuerza que atrae un electrón extra. Las afinidades electrónicas de los gases nobles no se han medido de forma concluyente, por lo que pueden o no pueden tener valores ligeramente negativos.
Afinidad electrónica aumenta generalmente a través de un período. Esto es causado por el llenado de la capa de valencia del átomo; un grupo de 17 lanzamientos de átomos más energía que un átomo de grupo 1 en ganar un electrón porque obtiene una capa de valencia llena y por lo tanto más estable es.
Se puede esperar que la tendencia decreciente de afinidad electrónica bajando grupos. El electrón adicional se entrando en un orbital más lejos del núcleo. Como tal, esta electrón menos atraídos por el núcleo y liberaría menos energía cuando se añade. Sin embargo, en la bajada por un grupo, alrededor de un tercio de los elementos son anómalas, con elementos más pesados que tienen afinidades electrónicas más altos que sus próximos congenors más ligeros. En gran parte, esto es debido a la mala blindaje por D y F electrones. Una disminución uniforme en afinidad electrónica sólo se aplica a los grupos 1 átomos.
Carácter metálico
Cuanto menores son los valores de la energía de ionización, electronegatividad y afinidad electrónica más metálico carácter el elemento tiene. Por el contrario, el carácter no metálico aumenta con mayores valores de estas propiedades. Dadas las tendencias periódicas de estas tres propiedades, carácter metálico tiende a decrecer va a través de un período y, con algunas irregularidades (en su mayoría), debido a la mala proyección del núcleo por dyf electrones, y efectos relativistas, tiende a aumentar bajando un grupo. Por lo tanto, los elementos más metálicos (tales como el cesio y francio ) se encuentran en la parte inferior izquierda de las tablas periódicas tradicionales y los elementos más metálicos ( oxígeno , flúor , cloro ) en la parte superior derecha. La combinación de las tendencias horizontales y verticales en carácter metálico explica la forma de escalera línea divisoria entre metales y no metales que se encuentran en algunas tablas periódicas, y la práctica de categorizar a veces varios elementos adyacentes a esa línea, o elementos adyacentes a esos elementos, como metaloides.
Historia
Primeros intentos de sistematización
En 1789, Antoine Lavoisier publicó una lista de 33 elementos químicos , agrupándolos en los gases , los metales , no metales, y tierras; Los químicos pasaron el siglo siguiente que buscaba para un esquema de clasificación más exacto. En 1829, Johann Wolfgang Döbereiner observó que muchos de los elementos se podrían agrupar en las tríadas en función de sus propiedades químicas. litio , sodio y potasio , por ejemplo, fueron agrupados juntos en una tríada tan suave, metales reactivos. Döbereiner también observó que, cuando era arreglado por el peso atómico, el segundo miembro de cada tríada era áspero la media del primera y el tercero; esto se conoce como la Ley de Tríadas. Químico alemán Leopold Gmelin trabajó con este sistema, y en 1843 él había identificado a diez tríadas, tres grupos de cuatro, y un grupos de cinco. Jean-Baptiste Dumas publicó el trabajo que describía en 1857 relaciones entre los diversos grupos de metales. Aunque los diversos químicos pudieran identificar relaciones entre los pequeños grupos de elementos, tenían todavía construir un esquema que los abarcó todos.
En 1858, el químico alemán Agosto Kekulé observado que de carbono a menudo tiene otros cuatro átomos unidos a ella. El metano , por ejemplo, tiene un átomo de carbono y cuatro átomos de hidrógeno. Este concepto eventual se conocía como valencia ; diferentes elementos de unión con diferentes números de átomos.
En 1862, Alexandre-Emile Beguyer de Chancourtois, geólogo francés, publicó una primera forma de tabla periódica, que él llamó la hélice telúrica o tornillo. Él fue la primera persona a notar la periodicidad de los elementos. Con los elementos dispuestos en una espiral sobre un cilindro por orden de aumentar el peso atómico, de Chancourtois mostró que los elementos con propiedades similares parecían ocurrir a intervalos regulares. Su tabla incluye algunos iones y compuestos en adición a los elementos. Su papel también utilizó geológica en lugar de términos químicos y no incluyó un diagrama; como resultado, recibió poca atención hasta que la obra de Dmitri Mendeleev .
En 1864, Julius Lothar Meyer, un químico alemán, publicó una tabla con 44 elementos dispuestos por valencia. La mesa mostró que los elementos con las propiedades similares compartieron a menudo la misma valencia. Al mismo tiempo, William Odling (un químico Inglés) publicó un arreglo de 57 elementos, ordenó sobre la base de sus pesos atómicos. Con algunas irregularidades y carencias, se dio cuenta de lo que parecía ser una periodicidad de pesos atómicos entre los elementos y que esta concede con 'sus agrupaciones generalmente recibidos.' Odling alude a la idea de una ley periódica, pero no insistió ella. Posteriormente propuso (en 1870) una clasificación basada en la valencia de los elementos.

Químico Inglés John Newlands produjo una serie de documentos de 1863 a 1866 y señaló que cuando los elementos se enumeran en orden de aumentar el peso atómico, las propiedades físicas y químicas similares se repitieron en los intervalos de ocho; comparó dicha periodicidad a la octavas de la música. Esto lo denomina Ley de octavas, sin embargo, fue puesta en ridículo por sus contemporáneos Newlands ', y la Chemical Society se negó a publicar su obra. Newlands, sin embargo fue capaz de elaborar una tabla de los elementos y la utilizó para predecir la existencia de elementos que faltan, como el germanio . La Sociedad Química sólo reconoció la importancia de sus descubrimientos cinco años después de que acreditan Mendeleev.
En 1867, Gustavus Hinrichs, un químico académico danés nacido con sede en Estados Unidos, publicó un sistema periódico espiral basada en espectros y los pesos atómicos y similitudes químicas. Su trabajo fue considerado como idiosincrásico, ostentosa y laberíntica y esto puede haber militado en contra de su reconocimiento y aceptación.
La tabla de Mendeleev


Profesor de química ruso Dmitri Mendeleev y químico alemán Julius Lothar Meyer publicó independientemente sus tablas periódicas en 1869 y 1870, respectivamente. La tabla de Mendeleev fue su primera versión publicada; la de Meyer era una versión ampliada de su mesa (Meyer) de 1864. Ambas construyeron sus tablas enumerando los elementos en filas o columnas en orden del peso atómico y comenzando una nueva fila o columna cuando las características de los elementos comenzaron a repetir .
El reconocimiento y la aceptación proporcionaron la tabla de Mendeleev vino a partir de dos decisiones que él tomó. El primer era dejar huecos en la tabla cuando parecía que el elemento correspondiente todavía no había sido descubierto. Mendeleev no era el primer químico a hacer así, pero él fue el primero en ser reconocido como usando las tendencias en su tabla periódica de predecir las propiedades de los elementos que faltan, tales como galio y germanio. La segunda decisión era ignorar la orden sugerida por los pesos atómicos y cambiar elementos adyacentes, como el telurio y yodo , para clasificarlos mejor en las familias químicas. Con el desarrollo de teorías de la estructura atómica, llegó a ser evidente que Mendeleev había enumerado involuntariamente los elementos en orden de aumentar número atómico o carga nuclear.
El significado de los números atómicos para la organización de la tabla periódica no fue apreciado hasta la existencia y las propiedades de los protones y los neutrones se convirtió entendido. Tablas periódicas de Mendeleev utilizan peso atómico en lugar de número atómico para organizar los elementos, información determinable a la precisión, hermoso en su tiempo. El peso atómico funcionó bastante bien en la mayoría de los casos a (como se indica) dar una presentación que fue capaz de predecir las propiedades de los elementos que faltan con más precisión que cualquier otro método conocido entonces. La sustitución de los números atómicos, una vez entendidas, dio una secuencia definitiva, basada en número entero de los elementos, que todavía se utiliza incluso como nuevos elementos sintéticos están siendo producidos y estudiados.
Mayor desarrollo

En 1871, Mendeleiev publicó una versión actualizada de la tabla periódica (que se muestra a la izquierda), así como dar predicciones detalladas de los elementos que había señalado anteriormente que faltaban, pero debería existir. Estas lagunas se llenan posteriormente como los químicos descubrieron elementos adicionales que ocurren naturalmente. A menudo se afirma que el último elemento natural que se descubrirá era francio (designado por Mendeleev el eka-cesio) en 1939. Sin embargo, el plutonio , producido sintéticamente en 1940, fue identificado en cantidades ínfimas como un elemento primordial de origen natural en 1971 , y en 2011 se encontró que todos los elementos hasta el californio pueden ocurrir naturalmente como trazas en minerales de uranio por captura de neutrones y la desintegración beta.
La disposición de la tabla periódica popular, también conocida como la forma común o estándar (como se muestra en varios otros puntos de este artículo), es atribuible a Horace Groves Deming. En 1923, Deming, un químico americano, publicado corto ( Estilo Mendeleiev) y medio ( 18-columna) forman tablas periódicas. Merck and Company prepararon un folleto forma de tabla media 18 columnas de Deming, en 1928, que fue ampliamente distribuido en las escuelas estadounidenses. Por la década de 1930 la mesa de Deming estaba apareciendo en los manuales y enciclopedias de la química. También se distribuyó durante muchos años por la Sargent-Welch Scientific Company.
Con el desarrollo de la moderna mecánica cuántica teorías de electrones configuraciones dentro de los átomos, se hizo evidente que cada periodo (fila) en la tabla correspondió al relleno de una cáscara del quántum de electrones. Átomos más grandes tienen más sub-cáscaras del electrón, por lo que más tarde las cosas han requerido períodos progresivamente más largos.

En 1945, Glenn Seaborg, un científico estadounidense, hizo la sugerencia de que los elementos actínidos , como los lantánidos se estaban llenando un subnivel f. Antes de este tiempo los actínidos se cree que la formación de una cuarta fila d-bloque. Los colegas de Seaborg aconseja él no publicar una sugerencia tan radical como lo más probable es arruinar su carrera. Como Seaborg consideró que no se tiene una carrera para llevar en el descrédito, publicó de todos modos. La sugerencia de Seaborg se encontró que era correcto y que posteriormente pasó a ganar el premio Nobel 1951 de Química por su trabajo en la síntesis de los elementos actínidos.
Aunque pequeñas cantidades de algunos elementos transuránicos se producen de forma natural, todos ellos fueron descubiertos por primera vez en los laboratorios. Su producción se ha expandido significativamente la tabla periódica, el primero de los cuales es el neptunio , sintetizado en 1939. Debido a que muchos de los elementos transuránicos son altamente inestables y decaimiento rápido, que son difíciles de detectar y caracterizar cuando se produce. Ha habido controversias relativas a la aceptación de descubrimiento competir reclamaciones por algunos elementos, lo que requiere una revisión independiente para determinar cuál de las partes tiene prioridad, y por lo tanto los derechos del nombre. Los elementos más recientemente aceptados y nombrados son Flerovium (elemento 114) y livermorium (elemento 116), ambos nombrados el 31 de mayo de 2012. En 2010, una colaboración conjunta entre Rusia y Estados Unidos en Dubna, Óblast de Moscú, Rusia, afirmó haber sintetizado seis átomos de ununseptium (elemento 117), por lo que es el descubrimiento más recientemente reivindicada.
Diseños alternativos

Hay muchas tablas periódicas con otros diseños que la de la forma común o estándar. A 100 años de la aparición de la tabla de Mendeleev en 1869 se ha estimado que se publicaron alrededor de 700 diferentes versiones de tabla periódica. Además de numerosas variaciones rectangulares, otros formatos de tablas periódicas han incluido, por ejemplo, circular, cúbica, cilíndrica, edificial (edificio-como), helicoidales, formas triangulares lemniscata, prismática octogonal, piramidal, separados, esférica, espiral, y. Tales alternativas se desarrollan a menudo para resaltar o enfatizar las propiedades químicas o físicas de los elementos que no son tan evidentes en las tablas periódicas tradicionales.
Una disposición alternativa popular es el de Theodor Benfey (1960). Los elementos están dispuestos en una espiral continua, con hidrógeno en el centro y los metales de transición, lantánidos, actínidos y de ocupación penínsulas.
La mayoría de las tablas periódicas son bidimensionales mesas embargo tridimensionales se sabe que ya en al menos 1862 (antes de la relación sexual tabla bidimensional de Mendeleiev de 1869). Ejemplos más recientes incluyen Clasificación Courtines 'periódico (1925), Sistema de Lamina de Wringley (1949), la hélice del Giguère periódico (1965) y Árbol periódico de Dufour (1996). Yendo un mejor, de la tabla periódica de Stowe Físico (1989) ha sido descrito como siendo de cuatro dimensiones (que tiene tres espaciales y una dimensión de color).
Las diversas formas de tablas periódicas pueden ser considerados como la mentira en un continuo de química-física. Hacia el final de química del continuo se puede encontrar, por ejemplo, la Tabla de Rayner-Canham 'rebelde' de Inorgánica Químico periódico (2002), que hace hincapié en las tendencias y patrones y relaciones químicas inusuales y propiedades. Cerca del final de la física del continuo es Tabla Periódica Izquierda-Paso de Janet (1928). Esto tiene una estructura que muestra una relación más estrecha con el orden de llenado de electrones de shell y, por asociación, la mecánica cuántica . En algún lugar en medio del continuo es la forma común o estándar ubicuo de la tabla periódica. Esto se considera como mejores que expresan tendencias empíricas en el estado físico, la conductividad eléctrica y térmica, y los números de oxidación, y otras propiedades fácilmente inferidas de las técnicas tradicionales de laboratorio químico.
| Janet tabla periódica a paso la izquierda | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s | H | Él | ||||||||||||||||||||||||||||||
| 2s | Li | Ser | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Nebraska | N / A | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Arkansas | K | California | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Minnesota | Fe | Co | Ni | Cu | Zn | Georgia | Ge | Como | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | CD | En | Sn | Sb | Te | YO | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Ue | Di-s | Tuberculosis | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Correos | En | Rn | Fr | Ra |
| 5f 6d 7p 8s | Corriente alterna | Th | Papá | U | Np | Pu | Soy | Cm | Bk | Cf | Es | Fm | Maryland | No | Lr | Rf | Db | Mx | Bh | Hs | Montana | Ds | Rg | Cn | Uut | Florida | Uup | Lv | Uus | Uuo | Uue | Ubn |
| f-bloque | d-bloque | p-bloque | s-bloque | |||||||||||||||||||||||||||||
| Esta forma de tabla periódica es más congruente con el orden en que capas electrónicas están llenas, como se muestra en la secuencia de acompañamiento en el margen izquierdo (leer de arriba a abajo, de izquierda a derecha). La colocación de helio (un gas noble) por encima de berilio (un metal alcalinotérreo) atrae normalmente fuertes críticas por parte de los químicos. | ||||||||||||||||||||||||||||||||
Preguntas abiertas y controversias
Los elementos con propiedades químicas desconocidas
Aunque todos los elementos hasta ununoctium se han descubierto, sólo los elementos hasta hassium (elemento 108), junto con copernicium (elemento 112), se han conocido las propiedades químicas. Los otros elementos pueden comportarse de manera diferente de lo que se predijo por extrapolación, debido a los efectos relativistas; por ejemplo, Flerovium ha sido predicho para exhibir posiblemente algunas propiedades noble-gas-como, a pesar de que se coloca actualmente en los grupo de carbono. experimentos más recientes han sugerido, sin embargo, que Flerovium se comporta químicamente como plomo, como se esperaba a partir de su posición de la tabla periódica.
Otras extensiones de la tabla periódica
No está claro si los nuevos elementos seguirán el patrón de la tabla periódica actual como período de 8, o requieren nuevas adaptaciones o ajustes. Seaborg espera que el octavo período, que incluye un elemento de dos s-bloque para los elementos 119 y 120, un nuevo g -Block para los próximos 18 elementos, y 30 elementos adicionales que continúan la f- actual, d-, y p-bloques. Más recientemente, los físicos como Pekka Pyykkö han teorizado que estos elementos adicionales no siguen la regla de Madelung, que predice cómo cáscaras de electrones están llenos y por lo tanto afecta a la apariencia de la actual tabla periódica.
Elemento con el número atómico más alto posible
No se conoce el número de elementos posibles. Una sugerencia muy temprana hecha por Elliot Adams en 1911, y en base a la disposición de los elementos en cada fila de la tabla periódica horizontal, era que los elementos de peso atómico superior a 256 ± (lo que equivaldría a entre 99 y 100 elementos en términos de hoy en día ) no existió. A-superior más reciente estimación es que la tabla periódica puede terminar poco después de la isla de estabilidad, que se espera para centrar alrededor elemento 126, como la extensión de las tablas periódicas y nucleidos está restringido por protones y neutrones líneas de goteo. Otras predicciones del fin a la tabla periódica incluyen al elemento 128 por John Emsley, al elemento 137 por Richard Feynman y al elemento 155 de Albert Khazan.
- Modelo de Bohr
La Modelo de Bohr exhibe dificultad para los átomos con número atómico superior a 137, ya que cualquier elemento con un número atómico superior a 137 requeriría 1s electrones para estar viajando más rápido que c , la velocidad de la luz . Por lo tanto el modelo de Bohr no relativista es inexacta cuando se aplica a un elemento tal.
- Ecuación de Dirac relativista
El relativista ecuación de Dirac tiene problemas para elementos con más de 137 protones. Para este tipo de elementos, la función de onda del estado fundamental de Dirac es oscilatoria en lugar de salto, y no hay diferencia entre el espectro de energía positiva y negativa, como en la paradoja de Klein. Cálculos más precisos teniendo en cuenta los efectos del tamaño finito del núcleo indican que la energía de enlace excede primero el límite para los elementos con más de 173 protones. Para los elementos más pesados, si los orbitales más interiores (1s) no está lleno, el campo eléctrico del núcleo se tire de un electrón a partir del vacío, resultando en la emisión espontánea de un positrón; sin embargo, esto no sucede si el orbital más interna se llena, de manera que elemento 173 no es necesariamente el final de la tabla periódica.
La colocación de hidrógeno y helio
El hidrógeno y el helio se colocan a menudo en diferentes lugares que sus configuraciones electrónicas indicarían; hidrógeno normalmente se coloca por encima de litio, de acuerdo con su configuración electrónica, pero a veces se coloca por encima de flúor , o incluso de carbono, ya que también se comporta un tanto similar a ellos. El hidrógeno también a veces se coloca en su propio grupo, ya que no se comporta de manera similar a cualquier elemento suficiente para ser colocado en un grupo con otro. El helio se coloca casi siempre por encima de neón , ya que son químicamente muy similares, aunque de vez en cuando se coloca por encima de berilio en la cuenta de que tiene una configuración comparable capa de electrones (helio: 1s 2 ; berilio: [Él] 2s 2 ).
Grupos incluidos en los metales de transición
La definición de un metal de transición , según lo dado por la IUPAC, es un elemento cuyo átomo tiene un d sub-shell incompleta, o que pueden dar lugar a cationes con un d sub-shell incompleta. Por esta definición todos los elementos en los grupos de 3-11 son metales de transición. Por consiguiente, la definición de la IUPAC excluye grupo 12, que comprende zinc, cadmio y mercurio, de la categoría de metales de transición.
Recuperado de " http://en.wikipedia.org/w/index.php?title=Periodic_table&oldid=545187902 "
