
Mercurio (elemento)
Sabías ...
SOS Children hizo esta selección Wikipedia junto a otros recursos de escuelas . Una rápida conexión para el apadrinamiento de niños es http://www.sponsor-a-child.org.uk/
| Mercurio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
80 Hg | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
plateado  Las líneas espectrales de mercurio (UV que no se ve) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | mercurio, Hg, 80 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / m ɜr k j del ər yo / MER -kyə-ree; / k w ɪ k s ɪ l v del ər /; / h aɪ d r ɑr dʒ ɨ r ə m / hi- Drar -ji-rəm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 12, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 200.59 (2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 5d 10 6s 2 2, 8, 18, 32, 18, 2 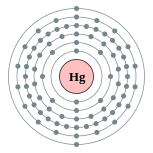 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Chinos e indios antiguo (antes de 2000 aC) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | líquido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 13.534 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 234.3210 K , -38.8290 ° C, -37.8922 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 629,88 K, 356.73 ° C, 674,11 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto Triple | 234.3156 K (-39 ° C), 1,65 × 10 -7 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 1750 K, 172,00 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 2.29 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 59,11 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 27.983 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 4, 2 (mercurio), 1 (mercurioso) (Levemente óxido básico) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,00 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 1007,1 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1810 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 3300 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 151 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 132 ± 17:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | rhombohedral  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (25 ° C) 961nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 8.30 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 60,4 m · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | (Líquido, 20 ° C) 1451,4 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7439-97-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de mercurio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El mercurio es un elemento químico con el símbolo Hg y número atómico 80. Se conoce comúnmente como el mercurio y fue nombrado anteriormente hydrargyrum (del griego " "el agua y" hydr- argyros "plata). Un pesado, plateado elemento d-bloque, el mercurio es el único metal que es líquido a condiciones normales de temperatura y presión; el único otro elemento que es líquido bajo estas condiciones es bromo , aunque los metales tales como el cesio , galio , y rubidio se derriten justo por encima de la temperatura ambiente. Con un punto de congelación de -38,83 ° C y el punto de ebullición de 356,73 ° C, el mercurio tiene una de las gamas más estrechas de su estado líquido de cualquier metal.
El mercurio se produce en depósitos en todo el mundo sobre todo como cinabrio ( sulfuro de mercurio). El pigmento rojo bermellón, una forma pura de sulfuro de mercurio, se obtiene principalmente mediante la reacción de mercurio (producido por reducción a partir del cinabrio) con azufre. El cinabrio es altamente tóxico por ingestión o inhalación del polvo. El envenenamiento por mercurio también puede resultar de la exposición a las formas solubles en agua de mercurio (como cloruro de mercurio o metilmercurio), la inhalación de vapor de mercurio, o comiendo mariscos contaminados con mercurio.
El mercurio se utiliza en termómetros, barómetros, manómetros, esfigmomanómetros, válvulas de flotador, interruptores de mercurio, lámparas fluorescentes y otros dispositivos, aunque las preocupaciones sobre la toxicidad del elemento han llevado a los termómetros y tensiómetros de mercurio están eliminando en gran parte a cabo en entornos clínicos en favor de alcohol , repleto, galinstan lleno, digital, o instrumentos basados en el termistor. Permanece en su uso en aplicaciones de investigación científica y en material de amalgama para restauración dental. Se utiliza en la iluminación: luz pasa a través de vapor de mercurio en una lámpara fluorescente produce de onda corta de luz ultravioleta que entonces hace que el fósforo en el tubo de fluorescencia, lo que la luz visible.
Propiedades
Propiedades físicas

El mercurio es un metal de color blanco plateado pesado. En comparación con otros metales, es un mal conductor de calor, pero un buen conductor de la electricidad. Mercurio tiene una fusión excepcionalmente baja y temperaturas de ebullición de un metal d-bloque. Una explicación completa de este se adentra profundamente en el reino de la física cuántica , pero se puede resumir de la siguiente manera: el mercurio tiene una configuración electrónica única en la que los electrones llenan todos los disponibles 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p , 4d, 4f, 5s, 5p, 5d y 6s subniveles. Como tal configuración resiste fuertemente la eliminación de un electrón, el mercurio se comporta de manera similar a los gases nobles elementos, que forman enlaces débiles y sólidos así fácilmente de fusión. La estabilidad de la cáscara 6s es debido a la presencia de una capa 4f lleno. Una cáscara f pantallas mal la carga nuclear que aumenta el atractivo interacción de Coulomb de la cáscara 6s y el núcleo (ver contracción de los lantánidos). La ausencia de una carcasa interior lleno f es la razón de la temperatura de fusión algo más alto de cadmio y zinc , aunque estos dos metales todavía fundir fácilmente y, además, tienen puntos de ebullición inusualmente bajos. Por otra parte, el oro , que es un espacio a la izquierda de mercurio en la tabla periódica, tiene átomos con uno menos de electrones 6s que el mercurio. Esos electrones se eliminan más fácilmente y son compartidos entre los átomos de oro formando relativamente fuerte enlaces metálicos.
Propiedades químicas
El mercurio no reacciona con la mayoría de los ácidos, tales como diluida de ácido sulfúrico , aunque ácidos oxidantes tales como concentrado de ácido sulfúrico y ácido nítrico o agua regia disolverlo para dar sulfato, nitrato, y sales de cloruro. Como la plata, mercurio reacciona con atmosférica sulfuro de hidrógeno. Mercurio incluso reacciona con copos de azufre sólido, que se utilizan en equipos de derrame de mercurio para absorber los vapores de mercurio (kits de derrame también utilizan carbón activado y polvo de zinc).
Las amalgamas

El mercurio se disuelve muchos otros metales como el oro y la plata para formar amalgamas. El hierro es una excepción y frascos de hierro se han utilizado tradicionalmente para el mercurio comercio. Varios otros metales de transición primera fila, con la excepción de manganeso , cobre y zinc son reacios a formar amalgamas. Otros elementos que no forman fácilmente con amalgamas de mercurio incluyen platino y algunos otros metales. La amalgama de sodio es un agente reductor común en Organic Synthesis, y también se utiliza en lámparas de sodio de alta presión.
El mercurio se combina fácilmente con el aluminio para formar una amalgama de mercurio y aluminio cuando los dos metales puros entran en contacto. Desde la amalgama destruye el óxido de aluminio que protege la capa de aluminio metálico se oxide en profundidad (como en hierro oxidación), incluso pequeñas cantidades de mercurio puede corroer gravemente aluminio. Por esta razón, el mercurio no se permite a bordo de una aeronave bajo la mayoría de circunstancias, debido al riesgo de que la formación de una amalgama con partes de aluminio expuestas en la aeronave.
Isótopos
Hay siete estables isótopos de mercurio con 202 Hg siendo el más abundante (29,86%). El más longevo radioisótopos son 194 Hg con una vida media de 444 años, y 203 Hg con una vida media de 46,612 días. La mayoría de los radioisótopos restantes tienen vidas medias que son menos de un día. 199 mmHg y 201 mmHg son los más frecuentemente estudiados RMN-núcleos activos, que tienen giros de 1/2 y 3/2, respectivamente.
Historia

El mercurio se encuentra en Egipto tumbas que datan de 1500 aC.
En China, y Tíbet , se pensaba que el uso del mercurio para prolongar la vida, curar fracturas, y mantener una buena salud en general, aunque ahora se sabe que la exposición al mercurio da lugar a efectos adversos para la salud graves. El primer emperador de China, Qín Shǐ Di de Huang - supuestamente enterrado en una tumba que contenía ríos de mercurio que fluye en un modelo de la tierra que él gobernó, representante de los ríos de China - fue muerto por beber una mercurio y polvo mezcla de jade formulada por Qin alquimistas (que causa insuficiencia hepática, envenenamiento por mercurio, y muerte cerebral) que tenían la intención de darle la vida eterna.
Los antiguos griegos utilizan mercurio en ungüentos; la antiguos egipcios y los romanos lo utilizaron en cosméticos que a veces deforman la cara. En Lamanai, una vez que una ciudad importante de la civilización maya , una piscina de mercurio fue encontrado debajo de un marcador en un Juego de pelota mesoamericano. Por el año 500 aC el mercurio se utiliza para hacer amalgamas (amalgama latín medieval ", aleación de mercurio") con otros metales.
Los alquimistas pensaron de mercurio como el Materia Prima de la que se formaron todos los metales. Se cree que los diferentes metales podrían ser producidos por la variación de la calidad y cantidad de azufre contenida dentro del mercurio. El más puro de éstos era de oro, y el mercurio se llamaba en los intentos de la transmutación de base (o impuros) metales en oro, que era el objetivo de muchos alquimistas.
Hg es el moderno símbolo químico para el mercurio. Viene de hydrargyrum, un latinizado forma del griego palabra Ύδραργυρος (hydrargyros), que es una palabra compuesta que significa "agua de plata" (agua = hydr-, argyros = plata) - ya que es líquido como el agua y brillante como la plata. El elemento fue nombrado en honor al dios romano Mercurio, conocido por su velocidad y movilidad. Se asocia con el planeta Mercurio ; el símbolo astrológico para el planeta es también uno de los símbolos alquímicos para el metal; la palabra sánscrita para la alquimia es Rasavātam que significa "el camino de mercurio". El mercurio es el único metal para que el nombre del planeta alquímico se convirtió en el nombre común.
Las minas en Almadén (España), Monte Amiata (Italia), y Idrija (hoy Eslovenia) dominó la producción de mercurio a partir de la apertura de la mina de Almadén hace 2500 años, hasta que se encontraron nuevos depósitos a finales del siglo 19.
Aparición
El mercurio es un elemento muy raro en la Tierra corteza , que tiene una abundancia de la corteza media en masa de sólo 0,08 partes por millón (ppm). Sin embargo, debido a que no se mezclan geoquímicamente con aquellos elementos que constituyen la mayoría de la masa de la corteza terrestre, los minerales de mercurio se pueden concentrar extraordinariamente teniendo en cuenta la abundancia del elemento en roca ordinaria. Los más ricos minerales de mercurio contienen hasta un 2,5% de mercurio en peso, e incluso los depósitos de concentrados más magros son al menos 0,1% de mercurio (12000 veces abundancia media de la corteza). Se encuentra ya sea como metal nativo (raro) o en cinabrio, corderoite, Livingstonita y otros minerales , con cinabrio (HgS) es el mineral más común. Los minerales de mercurio por lo general ocurren en muy jóvenes cinturones orogénicos donde la roca de alta densidad se ven obligados a la corteza de la Tierra, a menudo en aguas termales u otros volcánicas regiones.
Comenzando en 1558, con la invención de la proceso de patio para extraer la plata del mineral de usar mercurio, el mercurio se convirtió en un recurso esencial en la economía de España y sus colonias americanas. El mercurio se utiliza para extraer la plata de las minas lucrativas en Nueva España y Perú . Inicialmente, las minas de la Corona española en Almaden en el sur de España suministran todo el mercurio para las colonias. Depósitos de mercurio fueron descubiertas en el Nuevo Mundo, y más de 100.000 toneladas de mercurio fueron extraídos de la región de Huancavelica, Perú, a lo largo de tres siglos después del descubrimiento de depósitos de allí en 1563. El proceso de patio y después proceso de amalgamación pan continuó creando gran demanda de mercurio para tratar minerales de plata, hasta finales del siglo 19.

Antiguas minas en Italia , el Reino Unidos y México que en su día produjo una gran proporción de la oferta mundial ahora han sido completamente extraído a cabo o, en el caso de Eslovenia ( Idrija) y España ( Almadén), cerrado debido a la caída del precio del mercurio. Nevada de McDermitt Mina, la última mina de mercurio en los Estados Unidos, cerró en 1992. El precio del mercurio ha sido muy volátil en los últimos años y en el 2006 fue de $ 650 por 76 libras (34,46 kg) matraz.
El mercurio se extrae por calentamiento de cinabrio en una corriente de aire y condensar el vapor. La ecuación para esta extracción es
- HgS + O 2 → Hg + SO 2
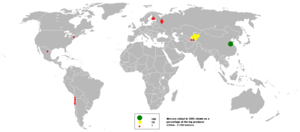
En 2005, China fue el principal productor de mercurio con casi dos tercios de la cuota global seguido de Kirguistán . Varios otros países se cree que tienen la producción no registrada de mercurio a partir de cobre electroobtención procesos y por la recuperación de los efluentes.
Debido a la alta toxicidad del mercurio, tanto en la minería de cinabrio y refinación de mercurio son causas peligrosas e históricos de la intoxicación por mercurio. En China, el trabajo penitenciario fue utilizado por una empresa minera privada en fecha tan reciente como la década de 1950 para crear nuevas minas de mercurio de cinabrio. Miles de prisioneros fueron utilizados por la empresa minera Luo Xi establecer nuevos túneles. Además, la salud de los trabajadores en las minas de funcionamiento está en alto riesgo.
La Unión Europea Directiva pidiendo compacto bombillas fluorescentes a ser obligatorias para el año 2012 ha alentado a China para reabrir las minas de cinabrio mortales para obtener el mercurio necesario para la fabricación bombilla CFL. Como resultado, los peligros ambientales han sido una preocupación, sobre todo en las ciudades del sur de Foshan y Guangzhou , y en el Provincia de Guizhou, en el suroeste.
Sitios de procesamiento de la mina de mercurio abandonadas a menudo contienen pilas de residuos muy peligrosos de cinabrio asado calcinados. El agua de escorrentía en dichos sitios es una fuente reconocida de daños ecológicos. Minas de mercurio Ex pueden ser adecuados para su reutilización constructiva. Por ejemplo, en 1976 Condado de Santa Clara, California compró el histórico Almaden Quicksilver Mina y creó un parque del condado en el sitio, después de realizar una exhaustiva seguridad y análisis ambiental de la propiedad.
Química
El mercurio existe en dos estados de oxidación principales, I y II. Estados de oxidación más altos no son importantes, pero se han detectado, por ejemplo, mercurio (IV) de fluoruro (HGF 4) pero sólo bajo condiciones extraordinarias.
Los compuestos de mercurio (I)
A diferencia de sus vecinos más ligeros, el cadmio y el zinc, mercurio forma compuestos estables simples con enlaces metal-metal. Los mercurio (I) son compuestos diamagnético y cuentan con el catión dimérica, Hg 2+
2. Derivados estables incluyen el cloruro y nitrato. Tratamiento de Hg (I) Los compuestos de complejos con ligandos fuertes tales como sulfuro, cianuro, etc. induce desproporción de Hg 2+ y el mercurio elemental. Mercurio (I) cloruro, un sólido incoloro también conocido como calomel, es realmente el compuesto con la fórmula Hg 2 Cl 2, con la conectividad Cl-Hg-Hg-Cl. Es un estándar en electroquímica. Se reacciona con el cloro para dar cloruro de mercurio, que se resiste a la oxidación adicional.
Indicativo de su tendencia a enlazar a sí mismo, las formas de mercurio policationes de mercurio, que consisten en cadenas lineales de centros de mercurio, tapados con una carga positiva. Un ejemplo es Hg 2+
3 (ASF -
6)
2.
Los compuestos de mercurio (II)
El mercurio (II) es el estado de oxidación más común y es la principal en la naturaleza también. Se conocen los cuatro haluros de mercurio. Los formularios complejos tetraédricos con otros ligandos pero los haluros adoptan geometría de coordinación lineal, algo así como Ag + hace. El más conocido es mercurio (II) cloruro, una facilidad sublimando sólido blanco. HgCl 2 formas complejos de coordinación que son típicamente tetraédrica, por ejemplo, 2- HgCl
4.
El mercurio (II) óxido, la principal óxido de mercurio, surge cuando el metal está expuesto al aire durante largos períodos a temperaturas elevadas. Se vuelve a los elementos por calentamiento cerca de 400 ° C, como lo demostró Sacerdotal en una síntesis temprana de puro oxígeno . Hidróxidos de mercurio están pobremente caracterizados, como lo son para sus vecinos de oro y plata.
Siendo un metal blando, derivados de las formas de mercurio muy estables con los calcógenos más pesados. Preeminente es mercurio (II) sulfuro, HgS, que se produce en la naturaleza como el mineral de cinabrio y es el pigmento brillante bermellón. Como ZnS, HgS cristaliza en dos formas, la forma cúbica de color rojizo y el negro forma blenda. El mercurio (II) seleniuro (HgSe) y mercurio (II) de teluro de (HgTe) también son conocidos, estos, así como diversos derivados, por ejemplo, mercurio teluro de cadmio y mercurio teluro de zinc siendo semiconductores útiles como materiales de detectores infrarrojos.
Sales de mercurio (II) forman una variedad de derivados complejos con amoniaco . Estos incluyen la base de Millon (Hg 2 N +), el polímero unidimensional (sales de HgNH +
2)
n), y "precipitado blanco fusible" o [Hg (NH 3) 2] Cl 2. Conocido como El reactivo de Nessler, tetraiodomercurate de potasio (II) (HGI 2-
4) está todavía en ocasiones se utiliza para probar para el amoníaco debido a su tendencia a formar la sal de yoduro de color profundo de la base de Millon.
Fulminato de mercurio es un detonador ampliamente utilizado en explosivos.
Estados de oxidación más altos
Estados de oxidación superiores a 2 en una especie no cargados son extremadamente raros, aunque un mercurinio cíclico (IV) de cationes, con tres sustituyentes, puede ser un intermediario en oximercuración reacciones. En 2007, un informe de síntesis de un (IV) compuesto de mercurio, mercurio (IV) de fluoruro, se publicó. En la década de 1970, hubo un reclamo sobre la síntesis de un compuesto de mercurio (III), pero ahora se cree que es falsa.
Compuestos organomercúricos
Orgánicos de mercurio compuestos son históricamente importantes, pero son de poco valor industrial en el mundo occidental. Sales de mercurio (II) son una rara ejemplos de complejos metálicos simples que reaccionan directamente con los anillos aromáticos. Compuestos organomercuriales son siempre divalente y por lo general de dos coordenadas y la geometría lineal. A diferencia de los compuestos organometálicos de cinc y organocadmio, compuestos organomercuriales no reaccionan con agua. Por lo general tienen la fórmula HgR 2, que a menudo son volátiles, o HgRX, que a menudo son sólidos, donde R es arilo o alquilo y X es generalmente haluro o acetato. El metilmercurio, un término genérico para los compuestos con la fórmula CH 3 HgX, es una familia de compuestos peligrosos que a menudo se encuentran en contaminado agua. Surgen por un proceso conocido como biometilación.
Aplicaciones

El mercurio se utiliza principalmente para la fabricación de productos químicos industriales o para aplicaciones eléctricas y electrónicas. Se utiliza en algunos termómetros, especialmente los que se usan para medir temperaturas elevadas. Una cantidad cada vez mayor aún se utiliza como el mercurio gaseoso en lámparas fluorescentes, mientras que la mayoría de las otras aplicaciones están eliminando lentamente debido a las regulaciones de salud y seguridad y se encuentra en algunas aplicaciones reemplazados con menos tóxico pero considerablemente más caro Galinstan aleación.
Medicina


El mercurio y sus compuestos se han utilizado en la medicina, aunque son mucho menos comunes hoy de lo que eran antes, ahora que los efectos tóxicos del mercurio y sus compuestos son más ampliamente entendidas. El elemento mercurio es un ingrediente en amalgamas dentales. El tiomersal (llamado timerosal en los Estados Unidos) es un compuesto orgánico utilizado como una conservante en vacunas, aunque este uso está en declive. Otro compuesto de mercurio Merbromina (mercurocromo) es un antiséptico tópico utilizado para pequeños cortes y rasguños está todavía en uso en algunos países.
Desde la década de 1930 algunos vacunas han contenido el conservante tiomersal, que se metaboliza o degrada a etil-mercurio. Aunque era especula extensamente que este conservante a base de mercurio puede provocar o desencadenar el autismo en los niños, los estudios científicos no mostró evidencia que apoya dichos enlaces. Sin embargo tiomersal ha sido suprimida o reducida a pequeñas cantidades en todas las vacunas recomendadas para los niños estadounidenses de 6 años de edad y menores, con la excepción de la vacuna antigripal inactivada.
Mercurio en la forma de uno de sus minerales comunes, cinabrio, se utiliza en diversas medicinas tradicionales, sobre todo en Medicina tradicional china. Revisión de su seguridad ha encontrado cinabrio puede conducir a la intoxicación por mercurio significativa cuando se calienta, se consume en sobredosis o tomado a largo plazo, y puede tener efectos adversos a dosis terapéuticas, aunque esto suele ser reversible a dosis terapéuticas. Aunque esta forma de mercurio parece menos tóxicos que otros, su uso en la medicina tradicional china todavía no ha sido justificada como base terapéutica para el uso de cinabrio no está claro.
Hoy en día, el uso de mercurio en la medicina ha disminuido mucho en todos los aspectos, especialmente en los países desarrollados. Termómetros y esfigmomanómetros que contienen mercurio fueron inventados a principios de los siglos 18 y finales de los años 19, respectivamente. A principios del siglo 21, su uso está disminuyendo y ha sido prohibido en algunos países, los estados y las instituciones médicas. En 2002, el Senado de Estados Unidos aprobó una ley para eliminar la venta de termómetros de mercurio sin receta. En el año 2003, Washington y Maine se convirtió en los primeros estados para prohibir los esfigmomanómetros de mercurio. Los compuestos de mercurio se encuentran en algunos over-the-counter medicamentos, incluyendo tópica antisépticos, laxantes estimulantes, pañales erupción ungüento, gotas para los ojos, y aerosoles nasales. La FDA tiene "datos suficientes para establecer el reconocimiento general de la seguridad y efectividad", de los ingredientes de mercurio en estos productos. El mercurio se utiliza todavía en algunos diuréticos, aunque ahora existen sustitutos para la mayoría de usos terapéuticos.
La producción de cloro y sosa cáustica
El cloro se produce a partir de cloruro de sodio (sal común, NaCl) utilizando la electrólisis para separar el metal de sodio desde el gas de cloro. Por lo general, la sal se disuelve en agua para producir una salmuera. Los subproductos de dicha proceso de cloro-álcali son hidrógeno (H 2) y el hidróxido de sodio (NaOH), que comúnmente se llama sosa cáustica o lejía. Por mucho, el mayor uso de mercurio en los finales del siglo 20 estaba en el proceso de celdas de mercurio (también llamado el Proceso Castner-Kellner) donde se forma el sodio metálico como amalgama en una cátodo hecho de mercurio; esta sodio se hace reaccionar con agua para producir hidróxido de sodio. Muchas de las emisiones de mercurio industriales del siglo 20 vinieron de este proceso, aunque las plantas modernas afirmaban ser seguro en este sentido. Después de cerca de 1985, todas las nuevas instalaciones de producción de cloro-álcali que se construyeron en los Estados Unidos utilizan ya sea celular o membrana de las tecnologías de células de membrana para producir cloro.
Usos de laboratorio
Algunos termómetros médicos, especialmente los de las altas temperaturas, están llenos de mercurio; sin embargo, están desapareciendo gradualmente. En los Estados Unidos, la venta sin receta de termómetros de mercurio está prohibido desde 2003.
Mercurio también se encuentra en telescopios de espejo líquido.
Algunos telescopios de tránsito utilizan una cuenca de mercurio para formar un espejo plano y absolutamente horizontal, útil en la determinación de una referencia vertical o perpendicular absoluta. Espejos parabólicos horizontales cóncavas pueden formarse mediante la rotación de mercurio líquido en un disco, la forma parabólica del líquido formado de este modo la reflexión y enfocar la luz incidente. Estos telescopios son más baratos que los grandes telescopios de espejo convencionales hasta en un factor de 100, pero el espejo no se pueden inclinar y siempre apunta hacia arriba.
El mercurio líquido es una parte de referencia secundaria populares electrodo (llamado electrodo de calomelanos) en electroquímica como una alternativa a la electrodo de hidrógeno estándar. El electrodo de calomelanos se utiliza para calcular la potencial de electrodo de células medio. Por último, pero no menos importante, la punto de mercurio triple, -38.8344 ° C, es un punto fijo utilizado como un estándar de temperatura para la escala de temperatura Internacional ( SU-90).
Usos de nicho


Mercurio gaseoso se utiliza en lámparas de vapor de mercurio y algunos " "signos tipo de publicidad letrero de neón y lámparas fluorescentes. Estas lámparas de baja presión emiten muy espectralmente líneas estrechas, que se utilizan tradicionalmente en la espectroscopía óptica para la calibración de la posición espectral. Lámparas de calibración comerciales se venden con este fin; sin embargo, simplemente refleja algo de la fluorescente lámpara de luz de techo en un espectrómetro de calibración es una práctica común. Mercurio gaseoso también se encuentra en algunos tubos de electrones, incluyendo ignitrones, tiratrones, y rectificadores de vapor de mercurio. También se utiliza en las lámparas de cuidados médicos especializados para el bronceado de la piel y desinfección (ver fotos). Mercurio gaseoso se añade a cátodo frío argón , repleto lámparas para aumentar la ionización y conductividad eléctrica. Una lámpara de argón lleno sin mercurio tendrá manchas opacas y dejará de iluminar correctamente. Iluminación contiene mercurio puede ser bombardeado / bombeado horno sólo una vez. Cuando se añade a neón tubos llenos de la luz producida será manchas rojas / azules inconsistentes hasta que se complete el proceso de grabación en inicial; finalmente, se iluminará un color opaco consistente-off azul.
Productos cosméticos
Mercurio, como tiomersal, se utiliza ampliamente en la fabricación de rímel. En 2008, Minnesota se convirtió en el primer estado de los EE.UU. para prohibir el mercurio añadido intencionadamente en los cosméticos, lo que supone una norma más dura que el gobierno federal.
Un estudio realizado en la concentración media de mercurio en la orina geométrica identificó una fuente previamente no reconocido de la exposición (productos para el cuidado de la piel) al mercurio inorgánico entre la ciudad de Nueva York residentes. Biomonitoreo de base poblacional también mostró que los niveles de concentración de mercurio son más altos en los consumidores de mariscos y pescado.
Usos históricos


Muchas aplicaciones históricas hacen uso de las propiedades físicas peculiares de mercurio, especialmente en forma de líquido denso y un metal líquido:
- Las cantidades de mercurio líquido que van desde 90 hasta 600 gramos (3,2 a 21 onzas) de se han recuperado de la élite maya tumbas o cachés rituales en seis sitios. Este mercurio puede haber sido utilizado en cuencos como espejos para fines adivinatorios. Cinco de ellos datan del período clásico de la civilización maya (c. 250-900), pero un ejemplo son anteriores a esta.
- En España islámica, fue utilizado para llenar piscinas decorativas. Más tarde, el artista estadounidense Alexander Calder construyó una Fuente de mercurio para el Pabellón Español de la Exposición Universal de 1937 en París. La fuente está ahora en exhibición en el Fundació Joan Miró de Barcelona, .
- El mercurio se usa en casa señuelos wobbler. Su forma pesada, líquido hizo útil ya que los señuelos hicieron un movimiento irregular atractivo cuando el mercurio se movió dentro del enchufe. Este uso se detuvo debido a las preocupaciones ambientales, pero se ha producido preparación ilegal de enchufes de pesca modernos.
- La Lentes de Fresnel de edad faros utilizan para flotar y girar en un baño de mercurio, que actuó como un cojinete.
- Mercurio esfigmomanómetros (metro de la presión arterial), barómetros, bombas de difusión, coulómetros, y muchos otros instrumentos de laboratorio. Como un líquido opaco con una alta densidad y una expansión térmica casi lineal, es ideal para este papel.
- Como un líquido eléctricamente conductor, que se utilizó en interruptores de mercurio (incluidos interruptores de luz de mercurio casa instalados antes de 1970), interruptores basculantes utilizados en detectores de fuego antiguas, y los interruptores de inclinación en algunos termostatos.
- Debido a sus propiedades acústicas, el mercurio se utilizó como medio de propagación en dispositivos de memoria de línea de retardo utilizados en las computadoras digitales tempranas de la mitad del siglo 20.
- Experimental Se instalaron turbinas de vapor de mercurio a aumentar la eficiencia de las plantas de energía eléctrica de combustibles fósiles. La planta de energía South Meadow en Hartford, CT emplea mercurio como su fluido de trabajo, en una configuración binaria con un circuito secundario de agua, para un número de años a partir de la década de 1920 en un intento por mejorar la eficiencia de la planta. Varias otras plantas fueron construidos, incluyendo la estación de Schiller en Portsmouth, NH, que se puso en línea en 1950. La idea no captó en toda la industria debido al peso y la toxicidad de mercurio, así como el advenimiento de plantas de vapor supercríticos en años posteriores.
- Del mismo modo, el mercurio líquido se utilizó como una refrigerante para algunos reactores nucleares; sin embargo, de sodio , se propone para los reactores enfriados con metal líquido, debido a la alta densidad de mercurio requiere mucha más energía para hacer circular como refrigerante.
- Mercurio era un propulsor para principios motores de iones en sistemas de propulsión espacial eléctrica. Ventajas eran de alto peso molecular de mercurio, de baja energía de ionización, baja energía de doble ionización, de alta densidad del líquido y la capacidad de almacenamiento de líquido en temperatura ambiente. Desventajas eran preocupaciones con respecto a impacto ambiental asociado con las pruebas y las preocupaciones sobre eventual enfriamiento y condensación de algunos de propelente en la nave espacial en las operaciones de larga duración suelo. El primer vuelo espacial de utilizar la propulsión eléctrica fue un ion mercurio propulsor alimentado desarrollado por NASA Lewis y volado en la Prueba de Rocket de espacio eléctrico " Nave espacial SERT-1 ", lanzada por la NASA en su Wallops Flight Facility en 1964. El SERT-1 vuelo fue seguido por el vuelo SERT-2 en 1970. El mercurio y cesio se prefiere propulsores para motores de iones hasta Laboratorio de Investigación Hughes realizó estudios que encuentran xenón gas para ser un reemplazo adecuado. El xenón es ahora el propulsor preferido para motores de iones, ya que tiene un peso molecular alto, poca o ninguna reactividad debido a su gas noble naturaleza, y tiene una alta densidad de almacenamiento criogénico líquido bajo suave.
Otras aplicaciones hacen uso de las propiedades químicas del mercurio:
- La batería de mercurio es un no recargable batería electroquímica, una célula primaria, que era común en todo el mediados del siglo 20a. Se utiliza en una amplia variedad de aplicaciones y estaba disponible en varios tamaños, en particular tamaños de botón. Su salida de tensión constante y larga vida útil le dieron un uso nicho para medidores de luz de la cámara y audífonos. La pila de mercurio fue prohibido de manera efectiva en la mayoría de los países de la década de 1990 debido a las preocupaciones sobre los vertederos contaminantes mercurio.
- El mercurio se utiliza para la conservación de la madera, el desarrollo de daguerrotipos, plateado espejos, pinturas antiincrustantes (interrumpidas en 1990), herbicidas (interrumpidas en 1995), juegos de laberinto de mano, limpieza, y los dispositivos de nivelación de pista en los coches. Los compuestos de mercurio se han utilizado en antisépticos, laxantes, antidepresivos, y en antisyphilitics.
- Fue presuntamente utilizado por espías aliados para sabotear aviones de la Luftwaffe: una pasta de mercurio se aplicó a desnudar aluminio , provocando que el metal rápidamente corroe ; esto causaría fallas estructurales.
- Proceso de cloruros alcalinos: El uso industrial más grande de mercurio durante el siglo 20 fue en la electrólisis para separar el cloro y el sodio de la salmuera; siendo el mercurio ánodo de la Proceso Castner-Kellner. El cloro se utiliza para el blanqueo de papel (por lo tanto la ubicación de muchas de estas plantas cerca de fábricas de papel), mientras que el sodio se utilizó para hacer hidróxido de sodio para jabones y otros productos de limpieza. Este uso ha sido descontinuado en gran parte, se sustituyen por otras tecnologías que utilizan células de la membrana.
- Como electrodos en algunos tipos de electrólisis , (baterías células de mercurio), hidróxido de sodio y cloro de producción, juegos de mano, catalizadores , insecticidas.
- Mercurio fue utilizado una vez como un cañón de la pistola llevaba más limpio.
- Desde mediados de los 18 hasta los siglos de mid-19a, un proceso llamado " carroting "se utiliza en la fabricación de sombreros de fieltro. Pieles de animales fueron lavadas en una solución naranja (el término "carroting" surgió de este color) del compuesto del mercurio nitrato de mercurio, Hg (NO 3) 2 · 2H 2 O. Este proceso separa la piel de la piel y enmarañado juntos. Esta solución y los vapores que producía eran altamente tóxicos. La Servicio de Salud Pública de los Estados Unidos prohibió el uso de mercurio en la industria de fieltro en diciembre de 1941. Los síntomas psicológicos asociados a la intoxicación por mercurio inspiraron la frase " loco como un sombrerero ". Lewis Carroll " Sombrerero Loco "en su libro Las aventuras de Alicia en el País de las Maravillas era un juego de palabras basado en la frase más viejo, pero el mismo carácter no presenta síntomas de la intoxicación por mercurio.
- El oro y la minería de la plata. Históricamente, el mercurio se utiliza ampliamente en la minería del oro hidráulico con el fin de ayudar al oro a hundirse a través de la mezcla de grava agua que fluye. Partículas de mercurio finas pueden formar la amalgama de mercurio-oro y, por tanto, aumentar las tasas de recuperación de oro. La utilización a gran escala de mercurio se detuvo en la década de 1960. Sin embargo, el mercurio todavía se utiliza en pequeña escala, a menudo clandestino, la búsqueda de oro. Se estima que 45.000 toneladas métricas de mercurio usado en California minería aluvial no se han recuperado. El mercurio también se utilizó en las minas de plata.
Usos medicinales históricos
(I) cloruro de mercurio (también conocido como calomel o cloruro mercurioso) se ha utilizado en la medicina tradicional como diurético, tópica desinfectante, y laxante. (II) cloruro de mercurio (también conocido como cloruro de mercurio o sublimado corrosivo) una vez que se utilizó para tratar la sífilis (junto con otros compuestos de mercurio), a pesar de que es tan tóxico que a veces los síntomas de su toxicidad se confundieron con los de la sífilis se creía de tratar. También se utiliza como desinfectante. de masa azul, una píldora o jarabe en el que el mercurio es el ingrediente principal, se prescribe durante todo el siglo 19a para numerosas condiciones incluyendo estreñimiento, depresión, niño-cojinete y el dolor de muelas. En el siglo 20, el mercurio se administró a los niños cada año como un laxante y desparasitante, y se utiliza en la dentición polvos para bebés. El organohaluro contienen mercurio merbromin (a veces se vende como mercurocromo) sigue siendo ampliamente utilizado, pero ha sido prohibido en algunos países como los EE.UU.
Toxicidad y seguridad
Mercurio y la mayoría de sus compuestos son extremadamente tóxicos y debe manejarse con cuidado; en casos de derrames que involucran mercurio (por ejemplo, de ciertos termómetros o bombillas fluorescentes), se utilizan procedimientos de limpieza específicos para evitar la exposición y contener el derrame. Protocolos exigen la fusión física gotas más pequeñas en superficies duras, que combina en una sola piscina más grande para facilitar su retiro con un cuentagotas, o para empujar suavemente el derrame en un recipiente desechable. Aspiradoras y escobas causan mayor dispersión del mercurio y no deben utilizarse. Después, bien de azufre , zinc , o algún otro polvo que se forma fácilmente una amalgama (aleación) con el mercurio a temperaturas ordinarias se esparcieron sobre el área antes de sí mismo que se recoge y apropiadamente desechados. Limpieza de superficies porosas y la ropa no es eficaz en la eliminación de todos los rastros de mercurio, por lo que se aconseja para descartar este tipo de artículos en caso de ser expuestos a un derrame de mercurio.
El mercurio puede ser absorbido por la piel y las membranas mucosas y los vapores de mercurio puede ser inhalado, por lo que los contenedores de mercurio están sellados de forma segura para evitar derrames y evaporación. El calentamiento de mercurio o de compuestos de mercurio que pueden descomponer al calentarse, siempre se lleva a cabo con una ventilación adecuada para evitar la exposición a los vapores de mercurio. Las formas más tóxicas de mercurio son sus compuestos orgánicos , tales como dimetilmercurio y metilmercurio. Compuestos inorgánicos, como el cinabrio son también altamente tóxico por ingestión o inhalación. El mercurio puede causar tanto la intoxicación crónica y aguda.
Estrenos en el medio ambiente
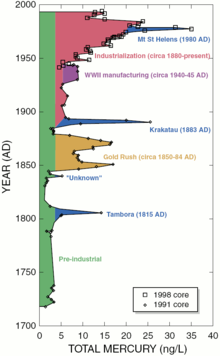
Tasas de deposición preindustriales de mercurio de la atmósfera pueden ser alrededor de 4 ng / (1 L del depósito de hielo). Aunque eso puede ser considerado como un nivel natural de la exposición, las fuentes regionales o globales tienen efectos significativos. Las erupciones volcánicas pueden aumentar la fuente atmosférica por 4-6 veces.
Las fuentes naturales, como los volcanes , son responsables de aproximadamente la mitad de las emisiones de mercurio a la atmósfera. El medio humano-generada se puede dividir en los siguientes porcentajes estimados:
- 65% a partir de la combustión estacionaria, de los cuales las plantas térmicas de carbón son la fuente del agregado más grande (40% de las emisiones de mercurio de Estados Unidos en 1999). Esto incluye las plantas de energía alimentadas con gas de las que no se ha eliminado el mercurio. Las emisiones procedentes de la combustión de carbón son entre uno y dos órdenes de magnitud superiores a las emisiones procedentes de la combustión de petróleo, dependiendo del país.
- 11% de la producción de oro. Las tres fuentes puntuales más importantes para las emisiones de mercurio en los EE.UU. son las tres minas de oro más grandes. Liberación hidrogeoquímica del mercurio de relaves de oro mina ha sido contabilizada como una fuente importante de mercurio atmosférico en el este de Canadá.
- El 6,8% dela producción de metales no ferrosos, típicamentefundiciones.
- 6,4% dela producción de cemento.
- 3.0% a partir dela eliminación de residuos, incluida lamunicipal yresiduos peligrosos,crematorios, yla incineración de lodos de depuradora.
- 3,0% desosa cáusticaproducción.
- 1.4% a partir dearrabio yacerode producción.
- 1,1% de la producción de mercurio, sobre todo para las baterías.
- 2,0% de otras fuentes.
Los porcentajes anteriores son estimaciones de las emisiones mundiales de mercurio de origen humano en 2000, con exclusión de la quema de biomasa, una fuente importante en algunas regiones.
La contaminación por mercurio atmosférico reciente en el aire urbano al aire libre se midió en 0,01 a 0,02 g / m 3 . A 2001 estudio midió los niveles de mercurio en 12 sitios interiores elegidos para representar una sección transversal de la construcción de tipos, lugares y edades en el área de Nueva York. Este estudio encontró concentraciones de mercurio significativamente elevados sobre concentraciones al aire libre, en un rango de 0,0065 a 0,523 g / m 3 . El promedio fue de 0,069 g / m 3 .
El mercurio también entra en el medio ambiente a través de la eliminación inadecuada (por ejemplo, vertederos, incineración) de determinados productos. Los productos que contienen mercurio son: piezas de automóviles, baterías, bombillas fluorescentes, productos médicos, termómetros y termostatos. Debido a problemas de salud (ver más abajo), uso de tóxicos de reducción de esfuerzos están reduciendo o eliminando el mercurio en estos productos. Por ejemplo, la cantidad de mercurio que se vende en los termostatos en los Estados Unidos disminuyó de 14,5 toneladas en 2004 a 3,9 toneladas en 2007. La mayoría de los termómetros ahora utilizan pigmentada de alcohol en lugar de mercurio, y los termómetros de aleación galinstan son muy también una opción. Los termómetros de mercurio siguen ocasionalmente utilizan en el campo de la medicina, ya que son más precisos que los termómetros de alcohol, aunque ambos comúnmente están siendo reemplazados por los termómetros electrónicos y con menos frecuencia por los termómetros galinstan. Los termómetros de mercurio siguen siendo ampliamente utilizados para ciertas aplicaciones científicas debido a su mayor precisión y rango de trabajo.
Históricamente, uno de los lanzamientos más grandes era de la planta Colex, una planta de separación de isótopos de litio-en Oak Ridge, Tennessee. La planta que opere en los años 1950 y 1960. Los registros son incompletos y poco clara, pero las comisiones gubernamentales han estimado que unos dos millones de libras de mercurio son desaparecidos.
Un grave desastre industrial fue el vertido de compuestos de mercurio en la bahía de Minamata, Japón. Se estima que más de 3.000 personas sufrieron diversas deformidades, síntomas de envenenamiento por mercurio graves o la muerte por lo que se conoce como la enfermedad de Minamata.
Exposicion ocupacional
Debido a los efectos en la salud de la exposición al mercurio, usos industriales y comerciales están regulados en muchos países. La Organización Mundial de la Salud , OSHA y NIOSH todos tratan mercurio como un riesgo laboral, y han establecido límites específicos de exposición ocupacional. Emisiones y eliminación del mercurio ambientales están reguladas en los EE.UU. principalmente por la Agencia de Protección Ambiental de los Estados Unidos.
Estudios de casos y controles han demostrado efectos como temblores, alteraciones habilidades cognitivas y trastornos del sueño en trabajadores con exposición crónica a vapores de mercurio, incluso a bajas concentraciones en el rango de 0,7 a 42 g / m 3 . Un estudio ha demostrado que la exposición aguda (4-8 horas) para calculadas niveles de mercurio elemental de 1,1 a 44 mg / m 3 dio lugar a dolor en el pecho, disnea, tos, hemoptisis, deterioro de la función pulmonar, y la evidencia de intersticial neumonitis. La exposición aguda a vapor de mercurio se ha demostrado que el resultado en profundos efectos en el sistema nervioso central, incluyendo reacciones psicóticas caracterizadas por el delirio, alucinaciones y tendencia suicida. La exposición ocupacional se ha plasmado en un amplio alcance perturbación funcional, incluyendo eretismo, irritabilidad, excitabilidad, timidez excesiva, y el insomnio. Con la exposición permanente, un temblor fino desarrolla y puede escalar a espasmos musculares violentos. Temblor implica inicialmente las manos y luego se extiende a los párpados, los labios y la lengua. A largo plazo, la exposición de bajo nivel se ha asociado con síntomas más sutiles de eretismo, incluyendo fatiga, irritabilidad, pérdida de memoria, sueños vívidos y depresión.
Tratamiento
La investigación sobre el tratamiento de la intoxicación por mercurio es limitado. Actualmente los fármacos disponibles para el envenenamiento mercurial agudo incluyen quelantes de N-acetil-D, L- penicilamina (NAP), British Anti-Lewisita (BAL), ácido 2,3-dimercapto-1-propanosulfónico (DMPS) y ácido dimercaptosuccínico (DMSA) . En un pequeño estudio incluyendo 11 trabajadores de la construcción expuestos al mercurio elemental, los pacientes fueron tratados con DMSA y NAP. La terapia de quelación con ambos fármacos como resultado la movilización de una pequeña fracción del mercurio total corporal estimado. DMSA fue capaz de aumentar la excreción de mercurio a un mayor grado que NAP.
Pescado
Pescado y crustáceos tienen una tendencia natural a concentrarse mercurio en sus cuerpos, a menudo en forma de metilmercurio, un compuesto orgánico altamente tóxicos de mercurio. Las especies de peces que se encuentran en lo alto de la cadena alimentaria, como el tiburón , pez espada, caballa, atún rojo, atún blanco, y blanquillo contienen mayores concentraciones de mercurio que otros. Como el mercurio y metilmercurio son solubles en grasa, se acumulan principalmente en el vísceras, aunque también se encuentran en todo el tejido muscular. Cuando este pescado es consumido por un depredador, el nivel de mercurio se acumula. Dado que los peces son menos eficientes en la depuradora de la acumulación de metilmercurio, las concentraciones de peces de tejidos aumentan con el tiempo. Por lo tanto las especies que son altos en la cadena alimentaria acumular carga corporal de mercurio que puede ser diez veces más altas que las especies que consumen. Este proceso se llama biomagnificación. El envenenamiento por mercurio sucedió de esta manera en Minamata, Japón , que ahora se llama la enfermedad de Minamata.
Reglamentos
Internacional
140 países acordaron la Convención de Minamata por el Programa de Naciones Unidas para el Medio Ambiente (PNUMA) para evitar las emisiones. Se espera Convención estará abierta a la firma en octubre de 2013.
Estados Unidos
En los Estados Unidos, la Agencia de Protección del Medio Ambiente se encarga de la regulación y la gestión de la contaminación por mercurio. Varias leyes dan la EPA esta autoridad, incluida la Ley de Aire Limpio, la Ley de Agua Limpia, la Ley de Conservación de Recursos y Recuperación, y la Ley de Agua Potable Segura. Además, el que contienen mercurio y la Ley de Gestión de la batería recargable, aprobada en 1996, retira paulatinamente el uso de mercurio en las pilas, y prevé la eliminación eficiente y rentable de los muchos tipos de baterías usadas. América del Norte contribuyó con aproximadamente 11% del total de las emisiones globales antropogénicas de mercurio en 1995.
Los Estados Unidos Clean Air Act, aprobada en 1990, puso de mercurio en una lista de contaminantes tóxicos que deben ser controlados en la mayor medida posible. Por lo tanto, las industrias que liberan altas concentraciones de mercurio en el medio ambiente de acuerdo en instalar tecnologías de control máximo alcanzable (MACT). En marzo de 2005, la EPA promulgó un reglamento que añadió las plantas de energía a la lista de fuentes que deben ser controlados y instituyeron un nacional sistema de cap and trade. Unidos se les dio hasta noviembre de 2006 para imponer controles más estrictos, pero después de un desafío legal de varios estados, las regulaciones fueron golpeados por un tribunal federal de apelaciones, el 8 de febrero de 2008. La regla se considerará que no sea suficiente para proteger la salud de las personas que viven cerca de plantas eléctricas de carbón, dados los efectos negativos documentados en el Informe de Estudio de la EPA al Congreso de 1998.
La EPA anunció nuevas reglas para las plantas eléctricas de carbón, el 22 de diciembre de 2011. Los hornos de cemento que queman residuos peligrosos se mantienen a un nivel más flojo que son estándarde residuos peligrososincineradores en los Estados Unidos, y como resultado son una fuente desproporcionado de mercurio la contaminación.
Unión Europea
En la Unión Europea , la Directiva sobre la restricción del uso de ciertas sustancias peligrosas en equipos eléctricos y electrónicos (ver RoHS) prohíbe el mercurio de ciertos productos eléctricos y electrónicos, y limita la cantidad de mercurio en otros productos a menos de 1000 ppm. Hay restricciones para la concentración de mercurio en los envases (el límite es de 100 ppm para la suma de mercurio, el plomo , el cromo hexavalente y cadmio ) y baterías (el límite es de 5 ppm). En julio de 2007, la Unión Europea también prohibió el mercurio en aparatos de medición no eléctricos, tales como termómetros y barómetros. La prohibición se aplica sólo a los nuevos dispositivos, y contiene exenciones para el sector de la salud y un período de gracia de dos años para los fabricantes de barómetros.
Noruega
Noruega promulgó una prohibición total del uso de mercurio en la fabricación e importación / exportación de productos de mercurio a partir del 1 de enero de 2008. En 2002, se encuentran varios lagos en Noruega a tener un mal estado de la contaminación por mercurio, con un exceso de 1 mg / g de mercurio en su sedimento. En 2008, el ministro de Medio Ambiente para el Desarrollo, Erik Solheim, de Noruega, dijo: "El mercurio es una de las toxinas ambientales más peligrosos. Alternativas satisfactorias a Hg en productos están disponibles, y por lo tanto es apropiado para inducir una prohibición ".
Suecia
Mercurio fue prohibido en Suecia en 2009.
Dinamarca
En 2008, Dinamarca también prohibió la amalgama de mercurio dental.
