
Cobre
Sabías ...
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. El patrocinio de los niños ayuda a los niños en el mundo en desarrollo para aprender también.
| Cobre | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
29 Cu | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||
rojo-naranja brillo metálico  Cobre nativo (~ 4 cm de tamaño) | ||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | cobre, Cu, 29 | |||||||||||||||||||||||||||||||||
| Pronunciación | / k ɒ p del ər / KOP -ər | |||||||||||||||||||||||||||||||||
| Categoría metálico | metal de transición | |||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 11, 4, d | |||||||||||||||||||||||||||||||||
| Peso atómico estándar | 63,546 (3) | |||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 3d 10 4s 1 2, 8, 18, 1 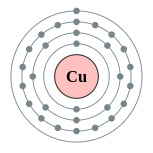 | |||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||
| Descubrimiento | Orientales Medio ( 9000 aC) | |||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 8,96 g · cm -3 | |||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 8,02 g · cm -3 | |||||||||||||||||||||||||||||||||
| Punto de fusion | 1357.77 K , 1084,62 ° C, 1984.32 ° F | |||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2835 K, 2562 ° C, 4643 ° F | |||||||||||||||||||||||||||||||||
| Calor de fusión | 13.26 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| El calor de vaporización | 300.4 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 24.440 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidación | 1, 2, 3, 4 (Levemente óxido básico) | |||||||||||||||||||||||||||||||||
| Electronegatividad | 1,90 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 745.5 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Segundo: 1957,9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Tercero: 3555 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Radio atómico | 128 pm | |||||||||||||||||||||||||||||||||
| Radio covalente | 132 ± 16:00 | |||||||||||||||||||||||||||||||||
| Van der Waals radio | 140 pm | |||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | |||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | |||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 16,78 nΩ · m | |||||||||||||||||||||||||||||||||
| Conductividad térmica | 401 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 16,5 m · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | ( rt) (recocido) 3810 m · s -1 | |||||||||||||||||||||||||||||||||
| El módulo de Young | 110-128 GPa | |||||||||||||||||||||||||||||||||
| Módulo de corte | 48 GPa | |||||||||||||||||||||||||||||||||
| Módulo de volumen | 140 GPa | |||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.34 | |||||||||||||||||||||||||||||||||
| Dureza de Mohs | 3.0 | |||||||||||||||||||||||||||||||||
| Dureza Vickers | 369 MPa | |||||||||||||||||||||||||||||||||
| Dureza Brinell | 874 MPa | |||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-50-8 | |||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de cobre | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
El cobre es un elemento químico con el símbolo Cu (del latín : Cuprum) y número atómico 29. Es un metal dúctil con muy alta térmica y conductividad eléctrica. El cobre puro es blando y maleable; una superficie recién expuesta tiene un color rojizo-anaranjado. Se utiliza como un conductor de calor y electricidad, un material de construcción, y un constituyente de diversos metales aleaciones.
El metal y sus aleaciones se han utilizado durante miles de años. En la época romana, el cobre se extraía principalmente en Chipre , de ahí el origen del nombre del metal como сyprium (metal de Chipre), más tarde acortado a сuprum. Sus compuestos se encuentran comúnmente como cobre (II) sales, que a menudo imparten colores azules o verdes a los minerales tales como azurita y turquesa y han sido ampliamente utilizados históricamente como pigmentos. Estructuras arquitectónicas construidas con corroe el cobre para dar verde cardenillo (o pátina). Arte decorativo ocupa un lugar destacado de cobre, tanto por sí mismo y como parte de los pigmentos.
El cobre es esencial para todos los organismos vivos como un rastro mineral de la dieta debido a que es un constituyente clave del complejo enzimático respiratorio citocromo c oxidasa. En moluscos y crustáceos cobre es un constituyente de la pigmento de la sangre hemocianina, que se sustituye por el hierro complejado- hemoglobina en los peces y otros vertebrados. Las principales áreas en las que el cobre se encuentra en los animales vertebrados son el hígado, los músculos y los huesos. En concentración suficiente, los compuestos de cobre son tóxicos para los organismos superiores y se utilizan como sustancias bacteriostáticas, fungicidas y conservantes de la madera.
Características
Físico


El cobre, la plata y el oro están en grupo 11 de la tabla periódica, y comparten ciertos atributos: tienen un electrón s-orbital en la parte superior de un d- lleno capa de electrones y se caracterizan por una alta ductilidad y la conductividad eléctrica. Los D-conchas llenas de estos elementos no contribuyen mucho a las interacciones interatómicas, dominados por los s-electrones a través de enlaces metálicos. Contrariamente a los metales con incompletas d-conchas, enlaces metálicos en cobre se carece de un covalentes carácter y son relativamente débiles. Esto explica la baja dureza y alta ductilidad de cristales simples de cobre. A escala macroscópica, la introducción de defectos extendida a la red cristalina, tales como los límites de grano, obstaculiza el flujo del material bajo tensión aplicada que aumenta su dureza. Por esta razón, el cobre se suministra normalmente en una de grano fino forma policristalino, que tiene mayor resistencia que formas monocristalinas.
La baja dureza del cobre en parte explica su alta conductividad eléctrica (59,6 × 10 6 S / m) y por lo tanto también de alta conductividad térmica, que son el segundo más alto entre los metales puros a temperatura ambiente. Esto es porque la resistividad de transporte de electrones en los metales a temperatura ambiente sobre todo origina a partir de la dispersión de los electrones en las vibraciones térmicas de la red, que son relativamente débil por un metal blando. La densidad de corriente máxima admisible de cobre en aire libre es de aproximadamente 3,1 × 10 6 A / m 2 de área de sección transversal, por encima del cual comienza a calentarse excesivamente. Como con otros metales, si el cobre se coloca en contra de otro metal, se produce corrosión galvánica.
Junto con el cesio y el oro (tanto amarillo) y osmio (azulada), el cobre es uno de los cuatro metales elementales con un color natural que no sea gris o plata. El cobre puro es de color naranja-rojo y adquiere un color rojizo empaña cuando se expone al aire. El color característico de los resultados de cobre de las transiciones electrónicas entre el 3d lleno y medio vacío conchas atómicas 4S - la diferencia de energía entre estas conchas es tal que corresponde a la luz de color naranja. El mismo mecanismo representa el color amarillo de oro y cesio.
Químico


El cobre forma una rica variedad de compuestos con estados de oxidación 1 y 2, que a menudo se llaman cuproso y cúprico, respectivamente. No reacciona con el agua, pero reacciona lentamente con el oxígeno atmosférico formando una capa de óxido de cobre de color marrón-negro. En contraste con la oxidación del hierro por el aire húmedo, esta capa de óxido detiene la corrosión mayor aún más. Una capa verde de verdín (carbonato de cobre) a menudo se puede ver en construcciones antiguas de cobre, tales como la Estatua de la Libertad, la estatua más grande de cobre en el mundo construido usando despreciado y arrojado. Cobre empaña cuando se expone a sulfuros de hidrógeno y otros sulfuros, que reaccionan con él para formar varios sulfuros de cobre en la superficie. Soluciones de amoniaco con oxígeno dan complejos solubles en agua con cobre, al igual que oxígeno y ácido clorhídrico para formar cloruros de cobre y se acidificó el peróxido de hidrógeno para formar sales de cobre (II). Cobre (II) cloruro y cobre comproportionate para formar cobre (I) de cloruro.
Isótopos
Hay 29 isótopos de cobre 63 Cu y 65 Cu son estables, con un 63 Cu que comprende aproximadamente el 69% de origen natural de cobre.; ambos tienen una espín de 3/2. Los otros isótopos son radiactivo, siendo el más estable 67 Cu con una vida media de 61,83 horas. Siete isótopos metaestables se han caracterizado, con 68m Cu el vivido más larga, con una vida media de 3,8 minutos. Isótopos con una número de masa por encima de 64 por caries β -, mientras que los que tienen un número de masa por debajo de 64 por caries β +. 64 Cu, que tiene una vida media de 12,7 horas, se desintegra en ambos sentidos.
62 Cu y 64 Cu tienen aplicaciones importantes. 64 es un Cu agente de radiocontraste para formación de imágenes de rayos X, y complejado con una quelato puede ser usado para el tratamiento del cáncer. 62 Cu se utiliza en 62 Cu-PTSM que es una trazador radioactivo para la tomografía por emisión de positrones.
Aparición
El cobre se sintetiza en las estrellas masivas y está presente en la corteza terrestre en una concentración de 50 partes por millón (ppm), donde se presenta como cobre nativo o en minerales tales como los sulfuros de cobre calcopirita y calcosina, carbonatos de cobre azurita y malaquita y la cobre (I) mineral de óxido cuprite. La mayor masa de cobre elemental descubierto pesaba 420 toneladas y se encontró en 1857 en el Península Keweenaw en Michigan, Estados Unidos. Cobre nativo es un policristalino, con el mayor descrito de cristal único de medición de 4,4 × 3,2 × 3,2 cm.
Producción



La mayor parte del cobre se extrae o extraído como sulfuros de cobre de gran minas a cielo abierto en depósitos de pórfidos de cobre que contienen 0,4 a 1,0% de cobre. Los ejemplos incluyen Chuquicamata en Chile , Bingham Canyon mina en Utah, Estados Unidos y El Chino Mina en Nuevo México, Estados Unidos. De acuerdo con la British Geological Survey, en 2005, Chile era el productor superior de la mina de cobre de al menos un tercio de las acciones del mundo, seguido de los Estados Unidos, Indonesia y Perú. El cobre también se puede recuperar a través de la In-situ proceso de lixiviación. Varios sitios en el estado de Arizona son los principales candidatos considerados para este método. La cantidad de cobre en uso es cada vez mayor y la cantidad disponible es apenas suficiente para permitir que todos los países alcancen los niveles del mundo desarrollado de uso.
Reservas
El cobre ha estado en uso por lo menos 10.000 años, pero más del 95% de todo el cobre extraído y fundido se ha extraído desde 1900. Al igual que con muchos recursos naturales, la cantidad total de cobre en la Tierra es enorme (alrededor de 10 14 toneladas sólo en el kilómetro superior de la corteza de la Tierra, o cerca de 5 millones años el valor de la tasa actual de extracción). Sin embargo, sólo una pequeña fracción de estas reservas es económicamente viable, teniendo en cuenta los precios actuales y tecnologías. Varias estimaciones de las reservas de cobre existentes para la minería varían desde 25 años hasta 60 años, dependiendo de los supuestos básicos, tales como la tasa de crecimiento. El reciclaje es una importante fuente de cobre en el mundo moderno. Debido a estos y otros factores, el futuro de la producción de cobre y la oferta es objeto de mucho debate, incluyendo el concepto de Cobre Peak, análoga a El pico del petróleo.
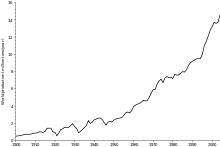
El precio del cobre ha sido históricamente inestable, y se quintuplicó desde el mínimo de 60 años de US $ 0.60 / libra (US $ 1.32 / kg) en junio de 1999 a US $ 3.75 por libra (US $ 8.27 / kg) en mayo de 2006. Se redujo a US $ 2.40 / libra (US $ 5.29 / kg) en febrero de 2007, y luego se recuperó a US $ 3.50 / libra (US $ 7.71 / kg) en abril de 2007. En febrero de 2009, el debilitamiento de la demanda mundial y una fuerte caída en los precios de los productos básicos desde los máximos del año anterior dejado los precios del cobre a US $ 1,51 / lb.
Métodos
La concentración de cobre en los minerales de promedios sólo el 0,6%, y la mayoría de los minerales de sulfuros son comerciales, especialmente de calcopirita (CuFeS 2) y en menor medida calcosina (Cu 2 S). Estos minerales se concentran desde minerales triturados al nivel de 10-15% de cobre por flotación de espuma o biolixiviación. Calefacción este material con sílice en fundición flash elimina gran parte del hierro como escoria. El proceso explota la mayor facilidad de conversión de sulfuros de hierro en sus óxidos, que a su vez reaccionan con la sílice para formar la escoria de silicato, que flota en la parte superior de la masa calentada. La mata de cobre resultante consiste en Cu 2 S es entonces asado a convertir todos los sulfuros en óxidos:
- 2 Cu 2 S + 3 O 2 → 2 Cu 2 O + 2 SO2
El óxido de cobre se convierte en cobre blister después de calentamiento:
- 2 Cu 2 O → 4 Cu + O 2
El Sudbury proceso mate convierte sólo la mitad del sulfuro en óxido y luego se usa este óxido para eliminar el resto del azufre como óxido. Fue entonces electrolíticamente refinado y el barro anódico explotado para el platino y oro que contenía. Este paso explota la relativamente fácil reducción de los óxidos de cobre a metal de cobre. El gas natural es soplado a través de la ampolla para eliminar la mayor parte del oxígeno que queda y electrolítico se realiza en el material resultante para producir cobre puro:
- Cu 2+ + 2 e - → Cu
Reciclaje
El cobre, como el aluminio, es 100% reciclable sin ninguna pérdida de calidad tanto en estado crudo o contenida en un producto manufacturado. En volumen, el cobre es el tercer metal más reciclado después del hierro y aluminio. Se estima que el 80% del cobre extraído está todavía en uso hoy en día. De acuerdo con la Internacional de Recursos del Grupo Especial de Las existencias del metal en el informe de la Sociedad, la acción per cápita mundial de cobre en uso en la sociedad es de 35-55 kg. Mucho de esto es en los países más desarrollados (140-300 kg per cápita) en lugar de los países menos desarrollados (30-40 kg por habitante).
El proceso de reciclaje de cobre sigue más o menos los mismos pasos que se utiliza para extraer el cobre, pero requiere menos pasos. De alta pureza cobre chatarra se funde en un horno y después reducida y echado en palanquillas y lingotes; chatarra de pureza inferior se refina mediante electrodeposición en un baño de ácido sulfúrico.
Aleaciones
Numeroso existen aleaciones de cobre, muchos de ellos con importantes usos. El latón es una aleación de cobre y zinc . Bronze generalmente se refiere a cobre- estaño aleaciones, pero puede referirse a cualquier aleación de cobre tal como bronce de aluminio. El cobre es uno de los constituyentes más importantes de quilates de plata y aleaciones de oro y quilates soldaduras utilizados en la industria de la joyería, modificando el punto de las aleaciones resultantes color, dureza y de fusión.
La aleación de cobre y níquel, llamado cuproníquel, se utiliza en baja denominación estatuas monedas , a menudo por el revestimiento exterior. Los EE.UU. moneda de 5 centavos llamada de níquel se compone de 75% de cobre y 25% de níquel y tiene una composición homogénea. El cobre / 10% de aleación de níquel 90% es notable por su resistencia a la corrosión y se utiliza en diversas partes de ser expuesto al agua de mar. Las aleaciones de cobre con aluminio (aproximadamente 7%) tienen un agradable color dorado y se utilizan en las decoraciones. Las aleaciones de cobre con estaño son parte de las soldaduras sin plomo.
Compuestos

Los compuestos binarios
En cuanto a otros elementos, los compuestos más simples de cobre son compuestos binarios, es decir, los que contienen sólo dos elementos. Los principales son los óxidos, sulfuros y haluros. Ambos cuproso y Se conocen óxidos cúpricos. Entre los numerosos sulfuros de cobre, ejemplos importantes incluyen de cobre (I) y sulfuro de sulfuro de cobre (II).
Los haluros cuprosos con cloro , bromo, y yodo son conocidos, como son los haluros cúpricos con flúor, cloro , y bromo. Los intentos para preparar cobre (II) de yoduro de dar yoduro cuproso y yodo.
- 2 Cu 2+ + 4 I - → 2 CuI + I 2
Química de la coordinación

Cobre, al igual que todos los metales, formas complejos de coordinación con ligandos. En solución acuosa, existe cobre (II) como [Cu (H 2 O) 6] 2+. Este complejo exhibe la tasa más rápida de cambio de agua (velocidad de ligandos de agua conectar y desconectar) para cualquier transición complejo aquo metal. Adición acuosa de hidróxido de sodio provoca la precipitación de luz azul fija hidróxido de cobre (II). Una ecuación simplificada es:
- Cu 2+ + 2 OH - → Cu (OH) 2
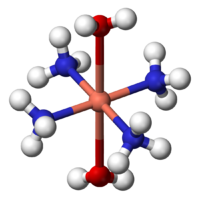
Resultados de amoníaco acuoso en el mismo precipitado. Tras la adición de exceso de amoniaco, el precipitado se disuelve, formando tetraamminecopper (II):
- Cu (H2O) 4 (OH) 2 + 4 NH3 → [Cu (H 2 O) 2 (NH3) 4] 2+ + 2 H2O + 2 OH -
Muchos otros oxianiones forman complejos; éstos incluyen de cobre (II) acetato de etilo, de cobre (II) nitrato , y de cobre (II) de carbonato. El cobre (II) sulfato forma un penta cristalino azul hidrato, que es el compuesto de cobre más familiar en el laboratorio. Se utiliza en una fungicida llamado Caldo bordelés.
Polioles, compuestos que contienen más de un alcohol grupo funcional, generalmente interactuar con sales cúpricas. Por ejemplo, sales de cobre se utilizan para probar azúcares reductores. Específicamente, el uso de Reactivo de Benedict y La solución de Fehling la presencia del azúcar es señalado por un cambio de color de azul Cu (II) a rojizo de cobre (I) de óxido. Reactivos y afines complejos de Schweizer con etilendiamina y otras aminas disolver celulosa. Los aminoácidos forman complejos de quelatos muy estables con cobre (II). Existen muchas pruebas de química húmeda para iones de cobre y una de éstas ferrocianuro de potasio, lo que da un precipitado de color marrón con cobre sales (II).
Organocobre química
Los compuestos que contienen un enlace carbono-cobre son conocidos como compuestos de organocobre. Ellos son muy reactivos hacia el oxígeno para formar de cobre (I) de óxido y tienen muchos usos en la química. Se sintetizan mediante el tratamiento de cobre (I) con compuestos Reactivos de Grignard, la terminal de alquinos o reactivos de organolitio; En particular, la última reacción descrita produce una Reactivo Gilman. Estos pueden someterse sustitución con haluros de alquilo para formar productos de acoplamiento; Como tales, son importantes en el campo de la síntesis orgánica. De cobre (I) acetiluro es altamente sensible al choque, pero es un intermediario en reacciones tales como la Acoplamiento Cadiot-Chodkiewicz y la Acoplamiento de Sonogashira. Además de conjugado a enonas y carbocupration de alquinos también se puede lograr con compuestos de organocobre. De cobre (I) forma una variedad de complejos débiles con alquenos y monóxido de carbono , especialmente en la presencia de ligandos de amina.
Cobre (III) y cobre (IV)
Cobre (III) se encuentra más característicamente en óxidos. Un ejemplo simple es el potasio cuprato, KCuO 2, un sólido azul-negro. Los mejores (III) compuestos de cobre estudiado son la superconductores de cuprato. YBCO (YBa 2 Cu 3 O 7) consiste tanto Cu (II) y Cu (III) centros. Como el óxido, el fluoruro es un anión altamente básico y es conocido para estabilizar los iones metálicos en los estados de oxidación altos. De hecho, tanto de cobre (III) e incluso de cobre (IV) fluoruros son conocidos, K 3 CuF 6 y Cs 2 CuF 6, respectivamente.
Algunas proteínas forman cobre complejos oxo, que también cuentan con cobre (III). Con di- y tri péptidos, cobre de color púrpura complejos (III) se estabilizan por el desprotonado ligandos amida.
Los complejos de cobre (III) se observan también como intermedios en reacciones de los compuestos de organocobre.
Historia
Edad del Cobre

El cobre se produce naturalmente como cobre nativo y se sabe que algunas de las civilizaciones más antiguas de la historia. Tiene un historial de uso de por lo menos 10.000 años de antigüedad, y las estimaciones de su lugar de descubrimiento que en 9000 aC en el Medio Oriente; un colgante de cobre se encuentra en el norte de Irak que se remonta a 8700 antes de Cristo. Hay pruebas de que el oro y la hierro meteórica (pero no la fundición de hierro) fueron los únicos metales utilizados por los seres humanos antes de cobre. Se piensa que la historia de la metalurgia del cobre haber seguido la siguiente secuencia: 1) trabajo en frío de cobre nativo, 2) recocido, 3) fundición, y 4) la método de la cera perdida. En el sudeste de Anatolia, los cuatro de estas técnicas metalúrgicas aparece más o menos simultáneamente al comienzo de la c neolítica. 7500 antes de Cristo. Sin embargo, al igual que la agricultura fue inventado independientemente en varias partes del mundo (incluyendo Pakistán, China y las Américas) de fundición de cobre fue inventado a nivel local en varios lugares diferentes. Probablemente fue descubierta independientemente en China antes de 2800 aC, en Centroamérica tal vez alrededor del año 600 DC, y en el África occidental sobre el noveno o décimo siglo DC. Bastidor de inversión fue inventado en 4500-4000 antes de Cristo en el sudeste de Asia y datación por carbono ha establecido la minería en Alderley Edge en Cheshire, Reino Unido en 2280-1890 antes de Cristo. Ötzi, un hombre que data del 3300-3200 aC, se encontró con un hacha con cabeza de cobre 99.7% de pureza; altos niveles de arsénico en el pelo sugieren su participación en la fundición de cobre. La experiencia con el cobre ha ayudado al desarrollo de otros metales; En particular, la fundición de cobre llevó al descubrimiento de la fundición de hierro. La producción en el Antiguo complejo de cobre en Michigan y Wisconsin está fechado entre 6000 y 3000 antes de Cristo. Bronce natural, un tipo de cobre a partir de minerales ricos en silicio, arsénico, y (rara vez) estaño, entró en uso general en los Balcanes alrededor de 5500 aC. Anteriormente la única herramienta de cobre había sido el punzón, que se utiliza para la perforación de agujeros en el cuero y sacarles los peg-agujeros para la madera unirse. Sin embargo, la introducción de una forma más robusta de cobre llevó al uso generalizado, y la producción a gran escala de las herramientas de metal pesados, incluyendo ejes, azuelas y hachas azuelas.
Edad De Bronce
La aleación de cobre con estaño para hacer bronce fue practicado primero unos 4000 años después del descubrimiento de la fundición de cobre, y cerca de 2000 años después de "bronce natural" habían entrado en uso general. Artefactos de bronce de sumerios y ciudades egipcias artefactos de cobre y aleaciones de bronce datan de 3000 AC. La Edad del Bronce comenzó en el sudeste de Europa en torno a 3700 - 3300 aC, en el noroeste de Europa alrededor de 2500 aC. Se terminó con el inicio de la Edad de Hierro, 2000-1000 aC en el Cercano Oriente, el año 600 aC en el norte de Europa. La transición entre el Neolítico y la Edad de Bronce fue antiguamente llamado el Calcolítico (cobre-piedra), con herramientas de cobre que se utiliza con herramientas de piedra. Este término ha caído gradualmente en desuso debido a que en algunas partes del mundo el Calcholithic y Neolítico son colindantes en ambos extremos. Latón, una aleación de cobre y zinc, es de origen mucho más reciente. Se sabe que los griegos, pero se convirtió en un complemento importante para el bronce durante el Imperio Romano.
Antigüedad y Edad Media

En Grecia, el cobre era conocido por los chalkos nombre (χαλκός). Era un recurso importante para los romanos, griegos y otros pueblos de la antigüedad. En la época romana, se le conocía como aes Cyprium, aes ser el término latino genérico para las aleaciones de cobre y Cyprium de Chipre , donde se extraía la cantidad de cobre. La frase se ha simplificado a Cuprum, de ahí el cobre Inglés. Afrodita y Venus representa el cobre en la mitología y la alquimia, debido a su belleza lustrosa, su antiguo uso en los espejos que producen, y su asociación con Chipre, que estaba consagrado a la diosa. Los siete cuerpos celestes conocidos de los antiguos se asociaron con los siete metales conocidos en la antigüedad, y Venus se asignó al cobre.
Primera utilización de Gran Bretaña de latón ocurrió alrededor del siglo 3ro-2do BC. En América del Norte, la minería del cobre comenzó con trabajos marginales por los nativos americanos. Cobre nativo se sabe que se han extraído de los sitios en Isle Royale con herramientas primitivas de piedra entre 800 y 1600. metalurgia del cobre estaba floreciendo en América del Sur, sobre todo en Perú alrededor del año 1000; se procedió a un ritmo mucho más lento en otros continentes. Cobre ornamentales funerarios del siglo 15 han sido descubiertos, pero la producción comercial de metal no comenzaron hasta principios del siglo 20.
El papel cultural del cobre ha sido importante, sobre todo en divisas. Romanos en el sexto a través de los siglos tercero antes de Cristo utiliza trozos de cobre como dinero. Al principio, el propio cobre fue valorado, pero poco a poco la forma y el aspecto del cobre se hizo más importante. Julio César tenía sus propias monedas hechas de latón, mientras que Octavio Augusto César monedas 's fueron hechas de aleaciones de Cu-Pb-Sn. Con una producción anual estimada de alrededor de 15.000 t, Actividades de minería y fundición de cobre romana alcanzó una escala sin igual hasta la época de la Revolución Industrial ; las provincias más intensamente minadas fueron las de Hispania, Chipre y en Europa Central.
Las puertas de la Templo de Jerusalén utilizado Bronce corintio hecha por dorado por oxidación. Fue más frecuente en Alejandría, donde se cree que la alquimia de haber comenzado. En la antigua India, se utilizó cobre en la ciencia médica holística Ayurveda para instrumentos quirúrgicos y otros equipos médicos. Los antiguos egipcios (~ 2400 aC) utilizaron el cobre para la esterilización de las heridas y el agua potable, y más tarde para los dolores de cabeza, quemaduras y picazón. La Bagdad batería, con cilindros de cobre soldadas al plomo, data de 248 aC a 226 dC y se asemeja a una pila galvánica, lo que lleva a la gente a creer que era la primera batería; la reclamación no ha sido verificada.
Edad Moderna

La Gran Montaña de Cobre fue una mina en Falun, Suecia, que operó desde el siglo 10 hasta 1992. Produjo dos tercios de la demanda de cobre de Europa en el siglo 17 y ayudó a financiar muchas de las guerras de Suecia durante ese tiempo. Se conoce como la tesorería de la nación; Suecia tenía una cobre moneda respaldada.
Los usos del cobre en el arte no se limitaron a la divisa: fue utilizado por renacentistas escultores, en la tecnología fotográfica conocida como la daguerrotipo, y el Estatua de la Libertad. Chapado en cobre y revestimiento de cobre para cascos de los barcos era generalizada; los barcos de Cristóbal Colón fueron de los primeros en tener esta característica. La Norddeutsche Affinerie en Hamburgo fue el primer moderno planta de galvanoplastia iniciar su producción en 1876. El científico alemán Gottfried Osann inventó metalurgia de polvos en 1830, mientras que la determinación de la masa atómica del metal; alrededor de entonces, se descubrió que la cantidad y el tipo de elemento de aleación (por ejemplo, estaño) al cobre afectarían tonos de campana. La fusión flash fue desarrollado por Outokumpu en Finlandia y aplicado por primera vez en Harjavalta en 1949; el proceso de bajo consumo representa el 50% de la producción primaria de cobre del mundo.
La Consejo Intergubernamental de Países Exportadores de Cobre, formada en 1967 con Chile, Perú, Zaire y Zambia, jugó un papel similar para el cobre como OPEP hace por aceite. Nunca logró la misma influencia, sobre todo porque el segundo mayor productor, los Estados Unidos, nunca fue miembro; que se disolvió en 1988.
Aplicaciones

Las principales aplicaciones del cobre se dan en los cables eléctricos (60%), techos y tuberías (20%) y maquinaria industrial (15%). El cobre se utiliza sobre todo como un metal, pero cuando se requiere una mayor dureza se combina con otros elementos para hacer una aleación (5% del uso total) como latón y bronce. Una pequeña parte de suministro de cobre se utiliza en la producción de compuestos para suplementos nutricionales y fungicidas en la agricultura. Mecanizado de cobre es posible, aunque por lo general es necesario el uso de una aleación para piezas complejas para obtener buenas características de maquinabilidad.
Alambre y cable
A pesar de la competencia de otros materiales, el cobre sigue siendo el preferido conductor eléctrico en casi todas las categorías de cableado eléctrico con la importante excepción de los gastos generales transmisión de energía eléctrica donde el aluminio se prefiere a menudo. El alambre de cobre se utiliza en poder de generación, transmisión de potencia, distribución de energía, las telecomunicaciones , la electrónica de circuitos, y un sinnúmero de tipos de equipo eléctrico. El cableado eléctrico es el mercado más importante para la industria del cobre. Esto incluye cable de construcción, comunicaciones por cable, cable de distribución de energía, alambre aparato, alambre y cable de la automoción, y alambre magneto. Aproximadamente la mitad de todo el cobre extraído se utiliza para la fabricación de conductores de hilos y cables eléctricos. Muchos dispositivos eléctricos dependen de cableado de cobre debido a su multitud de propiedades beneficiosas inherentes, tales como su alta conductividad eléctrica, resistencia a la tracción, ductilidad, la fluencia (deformación) de resistencia, la corrosión resistencia, baja expansión térmica, alta conductividad térmica, soldabilidad, y facilidad de instalación.

Los circuitos integrados y placas de circuito impreso cada vez disponen de cobre en lugar de aluminio debido a su conductividad eléctrica superiores (ver Interconexión de cobre para el artículo principal); disipadores de calor y intercambiadores de calor utilizan cobre como resultado de su superior capacidad de disipación de calor de aluminio. Electroimanes, tubos de vacío, tubos de rayos catódicos, y magnetrones en hornos de microondas utilizan cobre, al igual que guías de ondas para la radiación de microondas.
Motores eléctricos
Mayor de cobre conductividad frente a otros materiales metálicos mejora la eficiencia de energía eléctrica de motores. Esto es importante porque los motores y los sistemas accionados por motor representan el 43% -46% del consumo mundial de electricidad y el 69% de toda la electricidad utilizada por la industria. El aumento de la sección transversal de la masa y cobre en una bobina aumenta la eficiencia de la energía eléctrica del motor. Rotores de motores de cobre, una nueva tecnología diseñada para aplicaciones de motor donde el ahorro de energía son los objetivos de diseño de primera, están permitiendo de propósito general motores de inducción para satisfacer y exceder Asociación Nacional de Fabricantes Eléctricos (NEMA) normas de eficiencia superior.
Arquitectura


El cobre se ha utilizado desde la antigüedad como un durable, resistente a la corrosión , y material arquitectónico intemperie. Techos, tapajuntas, canales de la lluvia, bajantes, cúpulas, agujas, bóvedas, y puertas se han hecho de cobre durante cientos o miles de años. Uso arquitectónico del cobre se ha ampliado en los tiempos modernos para incluir interior y exterior revestimiento de paredes, edificio juntas de expansión, de radio frecuencia de blindaje, y productos de interior antimicrobianos, tales como barandillas atractivas, accesorios de baño, y encimeras. Algunos de los otros beneficios importantes de cobre como material arquitectónico incluyen su baja movimiento térmico, peso ligero, protección contra rayos , y su reciclabilidad.
Verde natural distintivo de El metal patina mucho tiempo ha sido codiciado por los arquitectos y diseñadores. La pátina final es una capa particularmente durable que es altamente resistente a la corrosión atmosférica, protegiendo así el metal subyacente contra la intemperie más. Puede ser una mezcla de compuestos de carbonato y sulfato en diversas cantidades, dependiendo de las condiciones ambientales tales como la lluvia ácida que contiene azufre. Cobre arquitectónico y sus aleaciones también pueden ser "Terminado" embarcar a una particular mirada, sentir y / o color. Los acabados incluyen tratamientos mecánicos de superficie, coloración química, y recubrimientos.
El cobre tiene excelente soldadura fuerte y propiedades de soldadura y pueden ser soldadas ; los mejores resultados se obtienen con la soldadura por arco metálico con gas .
Aplicaciones Antibiofouling
El cobre se ha utilizado como una superficie biostático a partes de la línea de buques para proteger contra los percebes y mejillones. Fue utilizado originalmente puro, pero desde entonces ha sido sustituido por De metal Muntz. Las bacterias no crecen en una superficie de cobre porque es biostático. Del mismo modo, como se discute en aleaciones de cobre en acuicultura, aleaciones de cobre se han convertido en material de red de importantes en el industria de la acuicultura debido al hecho de que son antimicrobiana y prevenir contaminación biológica, incluso en condiciones extremas y tienen fuertes estructurales y resistentes a la corrosión propiedades en ambientes marinos.
Aplicaciones antimicrobianos
Numerosos estudios de eficacia antimicrobiana se han realizado en los últimos 10 años respecto a la eficacia del cobre para destruir una amplia gama de bacterias, así como virus de la gripe A, adenovirus y los hongos .
Superficies de contacto de cobre-aleación tienen propiedades intrínsecas naturales para destruir una amplia gama de microorganismos (por ejemplo, E. coli O157: H7, resistente a la meticilina Staphylococcus aureus ( MRSA), Staphylococcus, Clostridium difficile, virus de la gripe A, adenovirus, y hongos ). Algunos 355 aleaciones de cobre fueron probados para matar a más del 99,9% de las bacterias que causan enfermedades en sólo dos horas cuando se limpian regularmente. La Agencia de Protección Ambiental de los Estados Unidos (EPA) ha aprobado los registros de estas aleaciones de cobre como " materiales antimicrobianos con beneficios para la salud pública ", que permite a los fabricantes hacen legalmente reclamaciones en cuanto a los beneficios positivos de salud pública de los productos hechos con aleaciones de cobre antimicrobiano registrados. Además, la EPA ha aprobado una larga lista de productos de cobre antimicrobiano hechos de estas aleaciones, tales como barandillas, pasamanos, mesas sobre-cama, sumideros, grifos, perillas de puertas, hardware aseo, teclados de ordenador, equipos de centro de bienestar, compra mangos comerciales, etc. (para una lista completa de productos, ver: Antimicrobiana de aleación de cobre en superficies de contacto # productos aprobados). Pomos de las puertas de cobre se usan por los hospitales para reducir la transferencia de la enfermedad, y La enfermedad del legionario es suprimida por la tubería de cobre en sistemas de plomería. Productos de aleaciones de cobre antimicrobiano ahora están siendo instalados en los centros de salud en el Reino Unido, Irlanda, Japón, Corea, Francia, Dinamarca y Brasil y en el sistema de transporte de metro en Santiago, Chile, donde se instalarán barandillas de aleación de cobre y zinc en un 30 estaciones entre 2011-2014.
Otros usos
Los compuestos de cobre en forma líquida se utilizan como conservante de la madera, especialmente en el tratamiento de la parte original de las estructuras durante la restauración de los daños causados por la podredumbre seca. Junto con zinc, cables de cobre se puede colocar sobre materiales de techado no conductores para impedir el crecimiento de musgo. Fibras textiles utilizan cobre para crear tejidos de protección antimicrobiana, al igual que esmaltes cerámicos, las vidrieras y los instrumentos musicales . Galvanoplastia comúnmente utiliza el cobre como base para otros metales como el níquel.
El cobre es uno de los tres metales, junto con el plomo y la plata, que se utiliza en un procedimiento de ensayo de materiales de museo llamado la prueba de Oddy. En este procedimiento, el cobre se utiliza para detectar cloruros, óxidos, y compuestos de azufre.
El cobre también se encuentra comúnmente en la joyería, y el folclore dice que las pulseras de cobre aliviarsíntomas de la artritis, aunque esto ha demostrado ser incorrecta.
El óxido de cobre y carbonato se utiliza enla fabricación de vidrioyesmaltes cerámicos para impartir colores verdes y marrones.
Papel biológico

Proteínas de cobre tienen diversos papeles en el transporte de electrones biológica y el transporte de oxígeno, los procesos que se aprovechan de la fácil interconversión de Cu (I) y Cu (II). El papel biológico para el cobre comenzó con la aparición del oxígeno en la atmósfera de la tierra. La proteína hemocianina es el portador de oxígeno en la mayoría de los moluscos y algunos artrópodos , como el cangrejo de herradura ( Limulus polyphemus ). Debido a la hemocianina es azul, estos organismos tienen sangre azul, no la sangre rojo que se encuentra en los organismos que dependen de la hemoglobina para este propósito. Estructuralmente relacionado con hemocianina son las lacasas y tirosinasas. En lugar de la unión reversible de oxígeno, estas proteínas sustratos hidroxilar, ilustrados por su papel en la formación de lacas.
El cobre es también un componente de otras proteínas asociadas con el procesamiento de oxígeno. En citocromo c oxidasa, que se requiere para aeróbico respiración, cobre y hierro cooperar en la reducción de oxígeno. El cobre también se encuentra en muchos superóxido dismutasas, proteínas que catalizan la descomposición de superóxidos, mediante la conversión (por desproporción) al oxígeno y peróxido de hidrógeno :
- 2 HO2→ H2O2+ O2
Varias proteínas de cobre, tales como las "proteínas de cobre azules", no interactúan directamente con los sustratos, por lo que no son enzimas. Estas proteínas transmiten electrones por el proceso llamado transferencia de electrones.
Necesidades dietéticas
El cobre es un elemento esencial elementos traza en las plantas y los animales, pero no algunos microorganismos. El cuerpo humano contiene cobre a un nivel de aproximadamente 1.4 a 2.1 mg por kg de masa corporal. Dicho de otra manera, la dosis diaria recomendada de cobre en adultos sanos normales es citado como 0,97 mg / día y como 3,0 mg / día. El cobre se absorbe en el intestino, entonces transporta al hígado unido a la albúmina. Después de procesar en el hígado, el cobre se distribuye a otros tejidos en una segunda fase. Transporte Copper aquí involucra la proteína ceruloplasmina, que lleva la mayoría de cobre en la sangre. La ceruloplasmina también lleva cobre que se excreta en la leche, y está particularmente bien absorbido-como una fuente de cobre. El cobre en el cuerpo normalmente se somete a la circulación enterohepática (alrededor de 5 mg al día, frente a alrededor de 1 mg por día absorto en la dieta y la excreta del cuerpo), y el cuerpo es capaz de excretar algún exceso de cobre, si es necesario, a través de la bilis, que lleva algo de cobre fuera del hígado que no es entonces reabsorbido por el intestino.
Trastornos a base de cobre
Debido a su papel en la facilitación de la absorción de hierro,deficiencia de cobre puede produciranemiasíntomas similares,neutropenia, anomalías óseas, hipopigmentación, alteraciones en el crecimiento, aumento de la incidencia de infecciones, osteoporosis, hipertiroidismo, y anormalidades en el metabolismo de la glucosa y el colesterol. Por el contrario, enfermedad de Wilson provoca una acumulación de cobre en los tejidos del cuerpo.
La deficiencia severa se puede encontrar pruebas de baja plasma o los niveles de cobre en suero, bajo ceruloplasmina, y los bajos niveles de superóxido dismutasa de glóbulos rojos; estos no son sensibles a la condición de cobre marginal. La "actividad c citocromo oxidasa de leucocitos y plaquetas" se ha declarado como otro factor en la deficiencia, pero los resultados no han sido confirmados por la replicación.
| NFPA 704 |
|---|
 0 2
0 |
| Diamante de fuego por un metal de cobre |
Cantidades en gramos de diversas sales de cobre se han tomado en intentos de suicidio y producido toxicidad aguda de cobre en los seres humanos, posiblemente debido a ciclo redox y la generación de especies reactivas de oxígeno que dañan el ADN . Cantidades correspondientes de sales de cobre (30 mg / kg) son tóxicos en animales. Se ha reportado un valor mínimo de la dieta para el crecimiento saludable en conejos que ser al menos 3 ppm en la dieta. Sin embargo, las concentraciones de cobre más elevadas (100 ppm, 200 ppm, o 500 ppm) en la dieta de los conejos pueden influir favorablemente la eficiencia de conversión de alimentación, tasas de crecimiento, y los porcentajes de apósito de la canal.
Toxicidad de cobre crónica normalmente no se produce en los seres humanos debido a los sistemas de transporte que regulan la absorción y excreción. Mutaciones recesivas autosómicas en proteínas de transporte de cobre pueden desactivar estos sistemas, lo que lleva a la enfermedad de Wilson con la acumulación de cobre y cirrosis del hígado en personas que han heredado dos genes defectuosos.

