
Trabajo (termodinámica)
Antecedentes
SOS Children produjo este sitio web para las escuelas, así como este sitio web video sobre África . ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| Termodinámica | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 El motor térmico clásico Carnot | |||||||||||||||||||||
Ramas | |||||||||||||||||||||
Sistemas Estado: Ecuación de estado Gas Ideal · Gas real Fase de la materia · Equilibrio Control de volumen · Instrumentos Procesos: Isobárica · Isócoro · Isotérmico Adiabático · Isoentrópica · Isoentálpica Cuasiestática · Polytropic Expansión gratuito La reversibilidad · Irreversibilidad Endoreversibility Ciclos: Motores térmicos · Las bombas de calor Eficiencia térmica | |||||||||||||||||||||
Propiedades del sistema Diagramas de Propiedad Propiedades intensivas y extensivas Funciones de estado: Temperatura / Entropía ( introducción. ) † Presión / † Volumen El potencial químico / Partículas no. † († Variables conjugadas) Título de vapor Propiedades reducidas Funciones de proceso: · Trabajo Calor | |||||||||||||||||||||
Propiedades materiales
| |||||||||||||||||||||
Ecuaciones El teorema de Carnot · Clausius teorema · Relación fundamental · Ley de los gases ideales · Relaciones de Maxwell · Las relaciones recíprocas de Onsager · Ecuaciones termodinámicas de Bridgman Tabla de ecuaciones termodinámicas | |||||||||||||||||||||
Potenciales La energía libre · Entropía gratuito
| |||||||||||||||||||||
Historia y cultura Filosofía: La entropía y el tiempo · Entropía y la vida Trinquete browniano El demonio de Maxwell Paradoja muerte Heat La paradoja de Loschmidt Sinergética Historia: Generales · Calor · Entropía · Leyes de los gases Movimiento continuo Teorías: Teoría calórica · Vis viva Teoría de calor Equivalente mecánico del calor La fuerza motriz Publicaciones: " Un Experimental Investigación sobre ... Heat " " En el equilibrio de sustancias heterogéneas " "Reflexiones sobre la Motive Poder del Fuego " Líneas de tiempo de: Termodinámica · Los motores térmicos Arte: Superficie termodinámica de Maxwell Educación: La entropía como dispersión de energía | |||||||||||||||||||||
En la termodinámica , el trabajo realizado por un sistema es la energía transferida por el sistema a otro que se explica por los cambios en las restricciones mecánicas generalizadas externos en el sistema. Como tal, el trabajo termodinámico es una generalización del concepto de trabajo mecánico en la mecánica.
Las restricciones mecánicas generalizadas externos pueden ser químicos, electromagnéticos (incluyendo radiativo, como en la potencia del láser), la gravedad, o la presión / volumen u otras limitaciones simplemente mecánicos, incluyendo momental, como en la transferencia de radiación. Trabajo termodinámico se define para ser medible únicamente a partir del conocimiento de tales variables de restricción macroscópicos externos. Estas variables macroscópicas siempre ocurren en pares conjugados, por ejemplo, presión y volumen, densidad de flujo magnético y magnetización, fracción molar y el potencial químico. En el Sistema de medida del SI, el trabajo se mide en julios (símbolo: J). La velocidad a la que se realiza el trabajo es de energía.
Historia
1824
Trabajo, es decir, "peso levantado a través de una altura", se definió originalmente en 1824 por Sadi Carnot en sus Reflexiones papel famosos en la fuerza motriz de Fuego. En concreto, según Carnot:
- Utilizamos aquí la fuerza motriz (trabajo) para expresar el efecto útil que un motor es capaz de producir. Este efecto siempre se puede comparar a la elevación de un peso a una cierta altura. Tiene, como sabemos, como medida, el producto del peso multiplicado por la altura a la que se crió.
1845

En 1845, el físico Inglés James Joule escribió un artículo sobre el equivalente mecánico del calor para la reunión de la Asociación Británica en Cambridge . En este trabajo, informó su experimento más conocido, en el que se utilizó el trabajo lanzado a través de la acción de un "peso que cae desde una altura" para activar una rueda de paletas en un cañón aislado de agua.
En este experimento, la fricción y la agitación de la rueda de paletas en el cuerpo del agua causada calor que se genera, que, a su vez, el aumento de la temperatura del agua. Tanto el cambio? T la temperatura del agua y la altura de la caída? H de los mg de peso se registraron. Usando estos valores, Joule fue capaz de determinar el equivalente mecánico del calor. Joule estima un equivalente mecánico del calor para ser 819 ft • lbf / BTU (4,41 J / cal). Las definiciones días modernos de calor, trabajo, la temperatura y la energía todos tienen conexión con este experimento.
Visión de conjunto
La primera ley de la termodinámica relaciona los cambios en la energía interna de un sistema termodinámico a dos formas de transferencia de energía.
El concepto de trabajo termodinámico es más general que el de simples trabajos mecánicos, ya que incluye otros tipos de transferencias de energía también. Un hecho muy importante a entender es que el trabajo termodinámico es estricta y completamente definido por sus variables mecánicas generalizadas externos. La otra forma de transferencia de energía es calor. El calor se mide por el cambio de temperatura de una cantidad conocida de sustancia material calorimétrico; es de la esencia de calor que no está definido por las variables mecánicas generalizadas externos que definen el trabajo. Esta distinción entre el trabajo y el calor es la esencia fundamental de la termodinámica .
El trabajo se refiere a formas de transferencia de energía que pueden ser explicados en términos de cambios en las limitaciones físicas macroscópicas externos en el sistema, por ejemplo la energía que entra en la expansión del volumen de un sistema contra una presión externa, por la conducción de un pistón de cabeza a cabo de un cilindro en contra de una fuerza externa. El trabajo eléctrico requerido para mover una carga contra un campo eléctrico externo se puede medir.
Esto es en contraste a calentar , que es la energía que se lleva dentro o fuera del sistema en la forma de transferencias en los movimientos térmicos microscópicos de partículas, o por radiación térmica. Hay sólo cinco formas de transferencia de calor: conducción, radiación , difusión, fricción, mayor y cizalla la viscosidad, y cambio de fase. Convección de la energía no es, como a veces equivocadamente se supone (una reliquia de la teoría del calórico), una forma de transferencia de calor, porque la convección no es en sí un movimiento microscópico de partículas microscópicas o fotones, pero es un flujo mayor de la materia ponderable con su energía interna. Debido a que, de acuerdo con la ley cero de la termodinámica, sólo hay un tipo de calor, es posible definir también un conjugado de la variable macroscópica a la temperatura, a saber, la entropía .
Definición formal
De acuerdo con la primera ley de la termodinámica, cualquier incremento neto de la energía interna U de un sistema termodinámico debe ser plenamente en cuenta, en términos de δQ calor que entran en el sistema y el δW trabajo realizado por el sistema:
La letra d indica una diferencial exacta, expresando que la energía interna U es una propiedad del estado del sistema; dependen solamente del estado original y el estado final, y no en el camino emprendido. En contraste, el griego de delta (δ 's) en esta ecuación refleja el hecho de que la transferencia de calor y la transferencia de trabajo no son propiedades del estado final del sistema. Teniendo en cuenta sólo el estado inicial y el estado final del sistema, sólo se puede decir lo que el cambio total en la energía interna era, no la cantidad de la energía que salió en forma de calor, y lo mucho que trabajo. Esto se puede resumir diciendo que el calor y el trabajo no son funciones de estado del sistema.
Trabajo presión-volumen
Trabajo presión-volumen, (o trabajo PV) se produce cuando el volumen (V) de un cambio de sistema. PV trabajo a menudo se mide en unidades de litro-atmósferas (no SI), en la que 1 L · atm = 101.325 J. Trabajo PV es un tema importante en termodinámica química.
pV trabajo está representado por la siguiente ecuación diferencial :
donde:
- W = trabajo realizado sobre el sistema
- p = presión
- V = volumen
La ecuación anterior de trabajo es válido para cualquier proceso reversible de una sistema cerrado.
Por consiguiente, la primera ley de la termodinámica se puede expresar como
Dependencia de la trayectoria
Como todas las funciones de trabajo, en general, PV trabajo es por lo tanto, dependiente de la trayectoria y es un termodinámico función de proceso. Sin embargo, en el caso específico de un reversible proceso adiabático, el trabajo no depende de la trayectoria. La primera ley de la termodinámica establece  . Para un proceso adiabático,
. Para un proceso adiabático,  y por lo tanto el trabajo realizado debe ser equivalente a un cambio en sólo energía interna, que es proporcional a la variación neta en la temperatura. Desde el trabajo sólo depende de el cambio de temperatura, por lo tanto, no depende de la ruta tomada específica.
y por lo tanto el trabajo realizado debe ser equivalente a un cambio en sólo energía interna, que es proporcional a la variación neta en la temperatura. Desde el trabajo sólo depende de el cambio de temperatura, por lo tanto, no depende de la ruta tomada específica.
Si el proceso tomó un camino que no sea el camino adiabática, el trabajo sería diferente. Esto sólo sería posible si el calor fluyó en / fuera del sistema, es decir, no sería adiabático. En un sistema dado, hay numerosos caminos entre dos temperaturas, y hay numerosos senderos que son adiabático. Pero sólo hay un camino adiabática entre dos temperaturas. Comenzando en algún temperatura inicial, cada trayectoria adiabática daría lugar a una temperatura final diferente. Pero entre dos temperaturas dadas, sólo hay un camino para  a ser cero, pero hay muchas maneras para que sea distinto de cero.
a ser cero, pero hay muchas maneras para que sea distinto de cero.
En términos matemáticos, el diferencial  es una diferencial inexacta; sin embargo, en el caso independiente ruta se puede demostrar ser una diferencial exacta. Una vez más desde la primera ley,
es una diferencial inexacta; sin embargo, en el caso independiente ruta se puede demostrar ser una diferencial exacta. Una vez más desde la primera ley,  . Tenga en cuenta que
. Tenga en cuenta que  para un proceso reversible, por lo tanto
para un proceso reversible, por lo tanto  , Que es exacta. Debido a que el diferencial de trabajo es exacta, el trabajo puede ser calculado de manera independiente del camino.
, Que es exacta. Debido a que el diferencial de trabajo es exacta, el trabajo puede ser calculado de manera independiente del camino.
Para ser más rigurosa, se debe escribir DJW (con una línea a través de la d). En otras palabras, no es un DJW exacto una sola forma. La formación a través de es simplemente una bandera para advertirnos en realidad no hay función ( 0-forma) 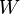 cuál es el potencial de DJW. Si la hubiera, de hecho, esta función
cuál es el potencial de DJW. Si la hubiera, de hecho, esta función 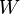 , Debemos ser capaces de utilizar sólo Stokes teorema para evaluar esta función putativo, el potencial de DJW, en el límite de la ruta, es decir, los puntos inicial y final, y por lo tanto el trabajo sería una función de estado. Esta imposibilidad es consistente con el hecho de que no tiene sentido para referirse a la obra en un punto en el diagrama pV; trabajo presupone un camino.
, Debemos ser capaces de utilizar sólo Stokes teorema para evaluar esta función putativo, el potencial de DJW, en el límite de la ruta, es decir, los puntos inicial y final, y por lo tanto el trabajo sería una función de estado. Esta imposibilidad es consistente con el hecho de que no tiene sentido para referirse a la obra en un punto en el diagrama pV; trabajo presupone un camino.
Energía y exergía gratuito
La cantidad de trabajo útil que puede ser extraída de un sistema termodinámico está determinada por la segunda ley de la termodinámica . Bajo muchas situaciones prácticas esto puede ser representado por la disponibilidad termodinámico, o Exergía, función. Dos casos importantes son: en los sistemas termodinámicos en que la temperatura y el volumen se mantiene constante, la medida de la utilidad alcanzable trabajo es el Función de energía libre de Helmholtz; y en sistemas donde la temperatura y la presión se mantiene constante, la medida de la utilidad alcanzable trabajo es la energía libre de Gibbs .



















