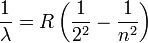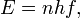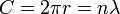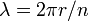Introducción a la mecánica cuántica
Sabías ...
Voluntarios SOS ayudaron a elegir artículos e hicieron otro material curricular Antes de decidir sobre el patrocinio de un niño, ¿por qué no aprender sobre diferentes obras de caridad de patrocinio primero ?
| Mecanica cuantica |
|---|
 La dualidad onda-partícula |
| Introducción Glosario · Historia |
Fondo
|
Conceptos fundamentales
|
Experimentos
|
Formulaciones
|
Ecuaciones
|
Interpretaciones
|
Temas avanzados
|
Los científicos
|

La mecánica cuántica (QM, o la teoría cuántica) es una ciencia física que trata con el comportamiento de la materia y la energía en la escala de átomos y partículas subatómicas / olas . QM también constituye la base para la comprensión contemporánea de objetos cómo muy grandes como estrellas y galaxias , y cosmológicas eventos como el Big Bang, puede ser analizado y explicado. La mecánica cuántica es la fundación de varias disciplinas conexas, incluida la nanotecnología, la física de la materia condensada , química cuántica , biología estructural, la física de partículas , y la electrónica .
El término "mecánica cuántica" fue acuñado por primera vez por Max Born en 1924. La aceptación por parte de la comunidad de la física general de la mecánica cuántica se debe a su predicción precisa del comportamiento físico de los sistemas, incluidos los sistemas donde la mecánica newtoniana falla. Incluso la relatividad general es limitada de manera mecánica cuántica es no-para describir sistemas a escala atómica o más pequeño, a energías muy bajas o muy altas, o a las temperaturas más bajas. A través de un siglo de experimentación y la ciencia aplicada, teoría de la mecánica cuántica ha demostrado ser muy exitoso y práctico.
Visión de conjunto
Los fundamentos de la mecánica cuántica datan de principios de 1800, pero los comienzos reales de fecha QM de la obra de Max Planck en 1900. Albert Einstein y Niels Bohr pronto hicieron importantes contribuciones a lo que ahora se llama la "teoría cuántica de edad." Sin embargo, no fue hasta 1924 que un cuadro más completo surgió con Louis de Broglie de hipótesis de la onda de materia y la verdadera importancia de la mecánica cuántica se hicieron evidentes. Algunos de los más prominentes científicos para contribuir posteriormente a mediados de la década de 1920 a lo que hoy se llama la "nueva mecánica cuántica" o "nueva física" fueron Max Born, Paul Dirac , Werner Heisenberg, Wolfgang Pauli, y Erwin Schrodinger. Más tarde, el campo se amplió aún más con el trabajo de Julian Schwinger, Shin'ichirō Tomonaga y Richard Feynman para el desarrollo de Electrodinámica Cuántica en 1947 y por Murray Gell-Mann, en particular, para el desarrollo de Cromodinámica cuántica.

Los primeros investigadores difieren en sus explicaciones de la naturaleza fundamental de lo que hoy llamamos la radiación electromagnética . Algunos sostuvieron que las frecuencias de luz y otras de la radiación electromagnética se componen de partículas, mientras que otros afirmaron que la radiación electromagnética es un fenómeno ondulatorio. En la física clásica estas ideas son mutuamente contradictorias. Desde los primeros días de los científicos QM han reconocido que ni idea por sí sola puede explicar la radiación electromagnética.
En 1690, Christian Huygens explicó las leyes de la reflexión y de la refracción sobre la base de una teoría ondulatoria. Sir Isaac Newton creía que la luz consistía en infinitesimalmente pequeñas partículas que él designe "corpúsculos". En 1827 Thomas Young y Augustin Fresnel hizo experimentos en la interferencia que mostró que una la teoría corpuscular de la luz era insuficiente. Luego, en 1873 James Clerk Maxwell mostró que, al hacer un circuito eléctrico oscile debería ser posible para producir ondas electromagnéticas. Su teoría hizo posible calcular la velocidad de la radiación electromagnética puramente sobre la base de medidas eléctricas y magnéticas, y el valor calculado correspondió muy de cerca a la empíricamente medido la velocidad de la luz . En 1888, Heinrich Hertz hizo un dispositivo eléctrico que realmente producimos lo que ahora llamaríamos microondas - la radiación esencialmente a un menor frecuencia que la luz visible. Todo hasta ese momento sugirió que Newton había sido del todo erróneo considerar la luz como corpuscular.
Experimentos posteriores indicaron que era necesario un modelo de paquete o cuántica para explicar algunos fenómenos. Cuando la luz incide en un conductor eléctrico que hace que los electrones a alejarse de sus posiciones originales. El fenómeno observado sólo podría explicarse por el supuesto de que la luz entrega energía en paquetes definidos. En un dispositivo fotoeléctrico como el medidor de luz en una cámara, luz que llega al detector metálico produce electrones para moverse. Mayor intensidades de luz en uno frecuencia puede causar más electrones que se mueven, pero no se moverá más rápido. En contraste, mayor frecuencias de la luz pueden causar los electrones se muevan más rápido. Ergo, la intensidad de los controles de luz actual, pero la frecuencia de los controles de luz voltaje. Estas observaciones plantean una contradicción si se compara con las ondas sonoras y las olas del mar, donde sólo la intensidad que se necesitaba para predecir la energía de la onda. En el caso de la luz, la frecuencia apareció para predecir la energía. Algo era necesaria para explicar este fenómeno y para conciliar los experimentos que habían mostrado luz para tener la naturaleza de las partículas con los experimentos que habían mostrado que tener onda de la naturaleza.
A pesar del éxito de la mecánica cuántica, que sí tiene algunos elementos polémicos. Por ejemplo, el comportamiento de los objetos microscópicos descritos en la mecánica cuántica es muy diferente de nuestra experiencia cotidiana, lo que puede provocar cierto grado de incredulidad. La mayor parte de la física clásica se reconoce ahora que se compone de los casos especiales de la teoría de la física cuántica y / o teoría de la relatividad. Dirac trajo teoría de la relatividad que soportar en la física cuántica para que pudiera tratar adecuadamente los eventos que ocurren en una fracción sustancial de la velocidad de luz. La física clásica, sin embargo, también se ocupa de atracción de masas (la gravedad), y hasta ahora nadie ha sido capaz de llevar la gravedad en una teoría unificada con la teoría cuántica relativizado.
Espectroscopia y hacia adelante
Es bastante fácil para ver un espectro producido por la luz blanca cuando pasa a través de un prisma, el borde biselado de un espejo o un panel cónico de vidrio, o por medio de gotas de lluvia para formar un arco iris. Cuando las muestras que se componen exclusivamente de un solo elemento químico, por ejemplo hidrógeno, son obligadas a emitir luz que pueden emitir luz a varias frecuencias características. El perfil de la frecuencia producida es característico de ese elemento. En lugar de estar allí una banda ancha llena de colores desde el violeta hasta el rojo, habrá bandas aisladas de colores individuales separadas por oscuridad. Dicha pantalla se denomina un espectro de líneas. Algunas líneas van más allá de las frecuencias visibles y sólo pueden ser detectados por la película fotográfica especial u otros tales dispositivos. Los científicos plantearon la hipótesis de que un átomo puede irradiar luz la forma en que la cuerda de un violín fino irradia sonido - no sólo con un frecuencia fundamental (en el que toda la cadena se mueve de la misma manera a la vez) pero con varios armónicos más altos (que se forma cuando la cadena se divide en dos mitades y otras divisiones que vibran en coordinación con los demás como cuando uno la mitad de la cadena se va de una manera como la otra mitad de la cadena va en sentido contrario). Durante mucho tiempo nadie pudo encontrar una manera matemática para relacionar las frecuencias del espectro de líneas de cualquier elemento.

En 1885, Johann Jakob Balmer (1825-1898) descubrió cómo las frecuencias de hidrógeno atómico están relacionados entre sí. La fórmula es sencilla:
donde  es la longitud de onda, R es la Rydberg constante y n es un número entero (n = 3, 4, ...) Esta fórmula se puede generalizar a aplicar a los átomos que son más complicados que el hidrógeno, pero se quedará con hidrógeno durante esta exposición general. (Esa es la razón por la que el denominador de la primera fracción se expresa como un cuadrado).
es la longitud de onda, R es la Rydberg constante y n es un número entero (n = 3, 4, ...) Esta fórmula se puede generalizar a aplicar a los átomos que son más complicados que el hidrógeno, pero se quedará con hidrógeno durante esta exposición general. (Esa es la razón por la que el denominador de la primera fracción se expresa como un cuadrado).
El siguiente desarrollo fue el descubrimiento de la Efecto Zeeman, el nombre de Pieter Zeeman (1865-1943). La explicación física del efecto Zeeman fue elaborado por Hendrik Antoon Lorentz (1853-1928). Lorentz la hipótesis de que la luz emitida por el hidrógeno se produce por la vibración de los electrones. Fue posible obtener información sobre lo que ocurre en el átomo de electrones que se mueven porque crean un campo magnético y por lo tanto puede ser influenciada por la imposición de un campo magnético externo de una manera análoga a la manera que un imán de hierro será atraer o repeler otro imán .
El efecto Zeeman podría interpretarse en el sentido de que las ondas de luz son originados por los electrones que vibran en sus órbitas, pero la física clásica no podía explicar por qué los electrones no deben caer fuera de sus órbitas y en el núcleo de sus átomos, ni podía física clásica explicar por qué su órbitas serían tales como para producir la serie de frecuencias discretas derivados por la fórmula de Balmer y se muestran en los espectros de línea. ¿Por qué los electrones no producen un espectro continuo?
La teoría cuántica Viejo
La mecánica cuántica desarrollados a partir del estudio de las ondas electromagnéticas a través de la espectroscopia , que incluye la luz visible se ve en los colores del arco iris, pero también otras ondas, incluyendo las olas más enérgicas como la luz ultravioleta, los rayos X y los rayos gamma y las ondas con longitudes de onda más largas que incluye infrarrojo ondas, horno microondas y ondas de radio. Solamente ondas que viajan a la velocidad de la luz se incluyen en esta descripción. Además, cuando se utiliza la palabra "partícula" a continuación, siempre se refiere a las partículas elementales o subatómicas.
La constante de Planck
La física clásica predijo que una radiador de cuerpo negro produciría energía infinita, pero ese resultado no fue observado en el laboratorio. Si la radiación del cuerpo negro se dispersó en un espectro, entonces la cantidad de energía radiada en varias frecuencias aumentó de cero en un extremo, alcanzó su punto máximo a una frecuencia relacionada con la temperatura del objeto radiante, y luego cayó de nuevo a cero. En 1900, Max Planck desarrolló una ecuación empírica que podría ser responsable de las curvas de energía observados, pero no pudo armonizarlo con la teoría clásica. Llegó a la conclusión de que las leyes clásicas de la física no se aplican en la escala atómica como se había supuesto anteriormente.
En esta cuenta teórica, Planck permitió todas las frecuencias posibles, todas las longitudes de onda posibles. Sin embargo, se limita la energía que se entrega. "En la física clásica, ... la energía de un oscilador dado depende simplemente en su amplitud, y esta amplitud está sujeta a ninguna restricción." Pero, según la teoría de Planck, la energía emitida por un oscilador es estrictamente proporcional a su frecuencia. Cuanto mayor sea la frecuencia, mayor es la energía. Para llegar a esta conclusión teórica, postuló que un cuerpo radiante consistía en un enorme número de osciladores elementales, algunos vibrando a una frecuencia y algunos en otro, con todas las frecuencias de cero a infinito estando representados. La energía E de cualquier oscilador no se le permitió tomar cualquier valor arbitrario, pero era proporcional a un múltiplo entero de la frecuencia f del oscilador. Esto es,
donde n = 1, 2, 3, ... La constante de proporcionalidad se denomina h La constante de Planck.
Una de las aplicaciones más directas es encontrar la energía de los fotones . Si h es conocido, y la frecuencia del fotón es conocida, entonces la energía de los fotones se puede calcular. Por ejemplo, si un haz de luz ilumina un objetivo, y su frecuencia fue de 540 × 10 12 hertz, entonces la energía de cada fotón sería h × 540 × 10 12 joules. El valor de h en sí es extremadamente pequeña, alrededor de 6.6260693 × 10 -34 segundo Joule. Esto significa que los fotones en el haz de luz tienen una energía de unos 3,58 × 10 -19 julios o (en otro sistema de medida) de aproximadamente 2,23 eV.
Cuando la energía de una onda se describe de esta manera, parece que la onda está llevando su energía en pequeños paquetes. Este descubrimiento luego pareció rehacer la ola en una partícula. Estos paquetes de energía realizadas junto con la onda fueron llamados quanta de Planck. La mecánica cuántica comenzó con el descubrimiento de que la energía se suministra en paquetes cuyo tamaño está relacionado con las frecuencias de todas las ondas electromagnéticas (y al color de la luz visible ya que en ese caso la frecuencia determina el color). Tenga en cuenta, sin embargo, que estas descripciones en términos de paquetes, onda y partícula de importación conceptos macro-mundo en el mundo cuántico, donde sólo tienen relevancia provisional o conveniencia.
En las primeras investigaciones sobre la luz, había dos maneras que compiten para describir la luz, ya sea como una onda que se propaga a través del espacio vacío, o partículas tan pequeñas que viajan en línea recta. Debido Planck mostró que la energía de la onda se compone de paquetes, la analogía de partículas llegó a ser favorecida para ayudar a entender cómo la luz entrega energía en múltiplos de ciertos valores de ajuste designados como cuantos de energía. Sin embargo, la analogía de onda también es indispensable para ayudar a entender otros fenómenos luminosos. En 1905, Albert Einstein utiliza la constante de Planck para explicar el efecto fotoeléctrico, postulando que la energía en un haz de luz se produce en concentraciones que llamó cuantos de luz, más tarde denominados fotones . De acuerdo a esa cuenta, un solo fotón de una frecuencia dada proporciona una cantidad invariable de energía. En otras palabras, los fotones individuales pueden entregar más o menos energía, pero sólo en función de sus frecuencias. Aunque la descripción que se deriva de la investigación de Planck suena como cuenta corpuscular de Newton, de fotones de Einstein fue todavía dice que tiene una frecuencia, y la energía del fotón fue contado proporcional a esa frecuencia. La cuenta de partículas había sido comprometida una vez más.
Tanto la idea de una onda y la idea de una partícula son modelos derivados de nuestra experiencia cotidiana. No podemos ver fotones individuales. Sólo podemos investigar sus propiedades indirectamente. Nos fijamos en algunos fenómenos, como el arco iris de colores que vemos cuando una fina película de aceite se basa en la superficie de un charco de agua, y podemos explicar ese fenómeno a nosotros mismos mediante la comparación de la luz con las olas. Nos fijamos en otros fenómenos, como la forma en que un metros fotoeléctrico en nuestra cámara funciona, y nos lo explique, por analogía, a las partículas que chocan con la pantalla de detección en el metro. En ambos casos se toma conceptos de nuestra experiencia cotidiana y los aplicamos a un mundo que nunca hemos visto.
Ninguna forma de explicación, onda o partícula, es totalmente satisfactoria. En general, cualquier modelo sólo puede aproximarse a aquello que modelos. Un modelo es útil sólo dentro de la gama de condiciones en las que es capaz de predecir la cosa real con precisión. física newtoniana sigue siendo un buen predictor de muchos de los fenómenos en nuestra vida diaria. Para recordarnos que tanto "ola" y "partícula" son conceptos importados de nuestro mundo macro para explicar el mundo de los fenómenos a escala atómica, algunos físicos como George Gamow haber utilizado el término " wavicle "para referirse a lo que sea que es realmente allí. En la siguiente discusión, "ola" y "partícula" pueden ser utilizadas dependiendo de qué aspecto de los fenómenos de la mecánica cuántica está en discusión.
(O de Dirac) constante de Planck reducida

La constante de Planck originalmente representada la energía que una onda de luz lleva como una función de su frecuencia. Un paso en el desarrollo de este concepto apareció en la obra de Bohr. Bohr estaba usando un modelo de partículas o "planetaria" del electrón, y no podía entender por qué un factor 2π era esencial para sus fórmulas derivadas experimentalmente. Más tarde, de Broglie postuló que los electrones tienen frecuencias, tal como lo hacen los fotones, y que la frecuencia de un electrón deben cumplir con las condiciones para una onda estacionaria que puede existir en un cierto órbita. Es decir, el comienzo de un ciclo de una onda en algún punto en la circunferencia de un círculo (ya que es lo una órbita es) debe coincidir con el final de algún ciclo. No puede haber una brecha, no longitud a lo largo de la circunferencia que no está participando en la vibración, y no puede haber superposición de ciclos. Así que la circunferencia de la órbita, C, debe ser igual a la longitud de onda, λ, del electrón multiplicado por algún entero positivo (n = 1, 2, 3 ...). Conocer la circunferencia se puede calcular longitudes de onda que se ajustan a esa órbita, y conociendo el radio, r, de la órbita se puede calcular su circunferencia. Para poner todo esto en forma matemática,
y entonces
y la aparición del factor 2π se ve que se produzca simplemente porque se necesita para calcular las posibles longitudes de onda (y por lo tanto posibles frecuencias) cuando el radio de una órbita ya se conoce.
De nuevo en 1925, cuando Werner Heisenberg desarrolló su teoría cuántica completa, los cálculos que incluyen análisis de ondas llamadas Series de Fourier son fundamentales, por lo que la versión "reducida" de constante (h / 2π) de Planck se convirtió en un valor incalculable, ya que incluye un factor de conversión para facilitar los cálculos que incluyen análisis de la onda. Finalmente, cuando esta reduce la constante de Planck apareció de manera natural en la ecuación de Dirac, entonces se le dio una denominación alternativa, "Dirac de constante". Por lo tanto, es conveniente comenzar con una explicación de lo que esta constante es, a pesar de que las teorías que hacen su uso más cómodo aún tienen que ser discutidos.
Como se señaló anteriormente, la energía de cualquier onda viene dada por su frecuencia multiplicada por la constante de Planck. Una onda se compone de crestas y valles. En una onda, un ciclo se define por el retorno desde una cierta posición a la misma posición tal como desde la parte superior de una cresta a la siguiente cresta. Un ciclo en realidad es matemáticamente relacionadas a un círculo, y ambos tienen 360 grados. Un grado es una unidad de medida de la cantidad de giro necesaria para producir un arco de una cierta longitud a una distancia dada. La curva sinusoidal se genera por un punto en la circunferencia de un círculo como ese círculo gira. (Vea una demostración en: Rotación Applet) Aún no radianes 2π por ciclo en una ola, que es matemáticamente relacionado con la forma en que un círculo tiene 360 ° (que son iguales a dos π radianes). (A radián es simplemente el ángulo si una distancia a lo largo de la circunferencia del círculo se mide igual al radio del círculo, y luego se trazan líneas al centro del círculo. Esto forma un ángulo igual a 1 radián.) Dado que uno ciclo es 2π radianes, cuando h es dividida por 2π los dos factores "2 π" se cancelará a cabo dejando sólo el radián que lidiar. Por lo tanto, dividiendo h por 2π describe una constante que, cuando se multiplica por la frecuencia de una onda, da la energía en julios por radián. La constante reducida de Planck está escrito en fórmulas matemáticas como H, y se lee como "h-bar".
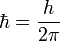 .
.
La constante de Planck reducida permite el cálculo de la energía de una onda en unidades por radian en lugar de en unidades por ciclo. Estas dos constantes h y H son más que factores de conversión entre unidades de energía y unidades de frecuencia. La reducción de la constante de Planck se utiliza más a menudo que h (la constante de Planck) solo en fórmulas matemáticas de la mecánica cuántica, por muchas razones, una de ellas es que la velocidad angular o frecuencia angular se mide habitualmente en radianes por segundo por lo que usar ħ que trabaja en radianes también lo hará guardar un cálculo para poner radianes en grados o viceversa. Además, cuando las ecuaciones relevantes para esos problemas se escriben en términos de H, los factores 2π que ocurren con frecuencia en el numerador y el denominador puede anular, el ahorro de un cálculo. Sin embargo, en otros casos, como en las órbitas del átomo de Bohr, se obtuvo h / 2π, naturalmente, para el momento angular de las órbitas. Otra expresión de la relación entre la energía y la longitud de onda se da en electrón-voltios de energía y angstroms de longitud de onda: E fotón (eV) = 12.400 / λ (A) - no parece implicar h en absoluto, pero eso es sólo porque una diferente sistema de unidades ha sido utilizado y ahora, numéricamente, el factor de conversión apropiado es 12.400.
Bohr átomo

En 1897 la partícula llamada electrón fue descubierto. Por medio de la los físicos experimento de la lámina de oro descubrieron que la materia es, volumen por volumen, en gran parte del espacio. Una vez que quedó claro, es la hipótesis de que las entidades de carga negativa llamadas electrones rodean carga positiva núcleos . Así que al principio todos los científicos creían que el átomo debe ser como un sistema solar en miniatura. Pero así de simple analogía predijo que los electrones sería, dentro de aproximadamente una centésima de microsegundo, accidente en el núcleo del átomo. La gran cuestión de principios del siglo 20 fue: "¿Por qué los electrones normalmente mantienen una órbita estable alrededor del núcleo?"
En 1913, Niels Bohr elimina este problema sustancial mediante la aplicación de la idea de los cuantos discretos (no continua) a las órbitas de los electrones. Esta cuenta se hizo conocido como el Modelo atómico de Bohr. Bohr básicamente la teoría de que los electrones sólo pueden habitar ciertas órbitas alrededor del átomo. Estas órbitas podrían derivarse mirando las líneas espectrales producidos por átomos.
Bohr explicó las órbitas que los electrones pueden tomar relacionando el momento angular de los electrones en cada órbita "permitidos" para el valor de h, la constante de Planck. Se consideró que un electrón en el orbital más bajo tiene un momento angular discreto igual a h / 2π. Cada órbita después de la órbita inicial debe proporcionar para el momento angular de un electrón es un múltiplo entero de que el valor más bajo. Él representa electrones en los átomos como análoga a los planetas en una órbita solar. Sin embargo, tomó la constante de Planck para ser una cantidad fundamental que introduce requisitos especiales en este nivel subatómico y que explica la separación de esas órbitas planetarias "".
Bohr considerada una revolución en la órbita para ser equivalente a un ciclo en un oscilador (como en mediciones iniciales de Planck para definir la constante h), que es a su vez similar a un ciclo de una onda. El número de revoluciones por segundo es (o define) lo que llamamos la frecuencia de ese electrón o que orbital. Especificando que la frecuencia de cada órbita debe ser un múltiplo entero de la constante h de Planck que sólo permiten ciertas órbitas, y sería también fijar su tamaño.
Bohr generalizada La fórmula de Balmer del hidrógeno mediante la sustitución denominador en el término cuarto con una variable al cuadrado explícito:
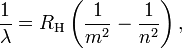 m = 1,2,3,4,5, ..., y n> m
m = 1,2,3,4,5, ..., y n> m
donde λ es la longitud de onda de la luz, R H es la Constante de Rydberg para el hidrógeno, y los números enteros n y m se refieren a las órbitas entre los cuales los electrones pueden tránsito. Esta generalización predijo muchos más líneas espectrales que se había detectado previamente, y la confirmación experimental de esta predicción siguió.
De ello se desprende casi inmediatamente que si  se cuantifica como la fórmula anterior indica, entonces el impulso de cualquier fotón debe cuantificarse. La frecuencia de la luz,
se cuantifica como la fórmula anterior indica, entonces el impulso de cualquier fotón debe cuantificarse. La frecuencia de la luz,  , A una longitud de onda dada
, A una longitud de onda dada  está dada por la relación
está dada por la relación
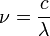 y:
y:  y multiplicando por h / h = 1,
y multiplicando por h / h = 1,
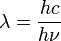 , Y sabemos que
, Y sabemos que
- E = hv lo
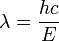 que podemos reescribir como:
que podemos reescribir como:
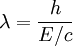 Y E / c = p (impulso) de modo
Y E / c = p (impulso) de modo
 o
o 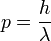
A partir de las líneas espectrales, los físicos pudieron deducir empíricamente las reglas según las cuales las órbitas de los electrones se determinan y descubrir algo vital sobre los ímpetus involucrados - que se cuantifican.
Bohr siguiente se dio cuenta de cómo el momento angular de un electrón en su órbita, L, está cuantizada, es decir, se determina que existe algún valor constante K tal que cuando se multiplica por la constante de Planck, h, se producirá el momento angular que pertenece al más bajo orbital. Cuando se multiplica por enteros sucesivos que luego le dan los valores de otros orbitales posibles. Más tarde se determinó que K = 1 / 2π. (Véase la discusión detallada en .)
La teoría de Bohr representado electrones orbitando alrededor del núcleo de un átomo de una manera que era sorprendentemente diferente de lo que vemos en el mundo de nuestra experiencia cotidiana. Demostró que cuando un electrón cambia órbitas no se movía en una trayectoria continua de una órbita alrededor del núcleo a otro. En su lugar, de repente desapareció de su órbita original y reapareció en otra órbita. Cada distancia a la que un electrón puede orbitar es una función de una cantidad cuantificada de la energía. Cuanto más cerca del núcleo un órbitas de los electrones, menos energía que se necesita para permanecer en esa orbital. Los electrones que absorben un fotón ganan un cuanto de energía, por lo que saltar a una órbita que está más lejos del núcleo, mientras que los electrones que emiten un fotón pierden un cuanto de energía y así saltar a un orbital interior. Los electrones no pueden ganar o perder un cuanto fraccional de energía, por lo que, se argumenta, que no pueden tener una posición que está a una distancia fraccional entre orbitales permitidos. Orbitales de compañía fueron designados como números enteros usando la letra n con el orbital más interna está designado n = 1, el siguiente a cabo siendo n = 2, y así sucesivamente. Cualquier orbital con el mismo valor de n se llama una capa de electrones.
Modelo del átomo de Bohr era esencialmente bidimensional, ya que representa los electrones como partículas en órbitas circulares. En este contexto, de dos dimensiones significa algo que puede ser descrito en la superficie de un avión. Unidimensional significa algo que puede ser descrito por una línea. Debido a que los círculos se pueden describir por su radio, que es un segmento de línea, a veces el modelo del átomo de Bohr se describe como unidimensional.
La dualidad onda-partícula

Niels Bohr determinó que es imposible describir la luz adecuadamente por el uso exclusivo de cualquiera de la analogía de la onda o de la analogía de partículas. Por lo tanto él enunció la principio de complementariedad, que es una teoría de pares, tales como el emparejamiento de onda y partícula o el emparejamiento de posición y el momento. Louis de Broglie elaborado las consecuencias matemáticas de estos hallazgos. En la mecánica cuántica, se encontró que las ondas electromagnéticas podrían reaccionar en ciertos experimentos como si fueran partículas y en otros experimentos como si fueran olas. También se descubrió que las partículas subatómicas a veces se podrían describir como partículas ya veces como ondas. Este descubrimiento llevó a la teoría de la dualidad onda-partícula de Louis-Victor de Broglie en 1924, que establece que las entidades subatómicas tienen propiedades tanto de ondas y partículas al mismo tiempo.
El modelo atómico de Bohr fue ampliada sobre con el descubrimiento por de Broglie que el electrón tiene propiedades ondulatorias. De acuerdo con las conclusiones de De Broglie, los electrones sólo pueden aparecer en condiciones que permitan una onda estacionaria. Una onda estacionaria se puede hacer si una cadena está fijado en ambos extremos y hace vibrar (como lo haría en un instrumento de cuerda). Ilustración que muestra que las únicas ondas estacionarias que pueden ocurrir son aquellos con amplitud cero en los dos extremos fijos. Las olas creadas por un instrumento de cuerda parecen oscilar en su lugar, simplemente cambiando cresta de depresión en un movimiento hacia arriba y hacia abajo. Una onda estacionaria sólo se puede formar cuando la longitud de la onda se ajusta a la entidad de vibración disponible. En otras palabras, no se permiten fragmentos parciales de crestas de las olas o depresiones. En un medio de vibración ronda, la onda debe ser una formación continua de crestas y valles de todo el círculo. Cada electrón debe ser su propia onda estacionaria en su propio discreto orbital.
El desarrollo de la mecánica cuántica moderna
Teoría de la mecánica cuántica completa
Werner Heisenberg hizo la teoría de la mecánica cuántica completo en 1925 a la temprana edad de 23. Después de su mentor, Niels Bohr, Werner Heisenberg comenzó a elaborar una teoría del comportamiento cuántico de orbitales electrónicos. Debido a que los electrones no se pudieron observar en sus órbitas, Heisenberg fue sobre la creación de una descripción matemática de la mecánica cuántica construidas sobre lo que se pudo observar, es decir, la luz emitida por los átomos en sus espectros atómicos característica. Heisenberg estudió el electrón orbital en el modelo de una bola cargada en un resorte, un oscilador, cuyo movimiento es anarmónico (no del todo regular). Para obtener una imagen del comportamiento de una bola cargada en un resorte, véase: Cargos por vibración. Heisenberg primero explicó este tipo de movimiento observado en términos de las leyes de la mecánica clásica conocida la aplicación en el mundo macro, y luego aplica restricciones cuánticas y discretas propiedades (no continuos), a la imagen. Si lo hace, las brechas a aparecer entre los orbitales previstas para que la descripción matemática formuló entonces representaría sólo el electrón orbitales predecir sobre la base de los espectros atómicos.
Al abordar el problema de que Bohr le dio para resolver, Heisenberg tomó la posición estratégica que no iba a tratar con cantidades observables. Él comenzaría formular ecuaciones usando sólo las cantidades que podrían ser observadas. Esa estrategia le llevó a comenzar con la evidencia experimental real en la mano: Mediciones habían sido bien establecido para datos tales como (1) las frecuencias (y las energías matemáticamente relacionadas) emitida o absorbida por las transiciones de electrones desde una de las órbitas estacionarias de Bohr, conocidos que se asocia con los espectros de línea brillante, (2) la "amplitud de transición" o la probabilidad de transición de cualquier órbita dada a cualquier órbita dado, conocido a partir de la fuerza de las distintas líneas en el espectro luminoso, etc. De fórmulas clásicas que se Caracterizar a los fenómenos Heisenberg crearon fórmulas análogas que tuvieron en cuenta las condiciones cuánticas. Fórmulas que siguieron desde las decisiones fundamentales en este punto dio lugar a buenos resultados, pero los resultados que a veces no es lo que uno podría esperar eran. En el documento en el que se introdujo la mecánica cuántica para el mundo, advierte, "surge una dificultad significativa, sin embargo, si tenemos en cuenta dos cantidades x (t), y (t), y pedir después de su producto .... Mientras que en x clásica (t) y (t) es siempre igual ay (t) x (t), esto no es necesariamente el caso en la teoría cuántica ". Cuando los valores predichos se exhiben en forma de matriz y multiplicaciones se realizan, la naturaleza de la dificultad aparece en una forma que es más familiar para los matemáticos.Más significativamente, los estudios empíricos validan los resultados teóricos y sugieren que hay algo de profunda importancia en la que la diferencia entre x (t) y (t) ey (t) x (t) es un valor relacionado con la constante de Planck.
Esquema para una tabla de frecuencias de transición (que se produce cuando los electrones cambian orbitales):
| Electron Unidos | S1 | S2 | S3 | S4 | S5 | .... | |
|---|---|---|---|---|---|---|---|
| S1 | f1 → 1 | f2 → 1 | f3 → 1 | f4 → 1 | f5 → 1 | ..... | |
| S2 | f1 → 2 | f2 → 2 | f3 → 2 | f4 → 2 | f5 → 2 | ..... | |
| S3 | f1 → 3 | f2 → 3 | f3 → 3 | f4 → 3 | f5 → 3 | ..... | |
| S4 | f1 → 4 | f2 → 4 | f3 → 4 | f4 → 4 | f5 → 4 | ..... | |
| S5 | f1 → 5 | f2 → 5 | f3 → 5 | f4 → 5 | f5 → 5 | ..... | |
| S ..... | ..... | ..... | ..... | ..... | ..... | ..... |
Esquema para una tabla relacionada que muestra las amplitudes de transición:
| Electron Unidos | S1 | S2 | S3 | S4 | S5 | .... | |
|---|---|---|---|---|---|---|---|
| S1 | a1 → 1 | a2 → 1 | a3 → 1 | a4 → 1 | a5 → 1 | ..... | |
| S2 | a1 → 2 | a2 → 2 | a3 → 2 | a4 → 2 | a5 → 2 | ..... | |
| S3 | a1 → 3 | a2 → 3 | a3 → 3 | a4 → 3 | a5 → 3 | ..... | |
| S4 | a1 → 4 | a2 → 4 | a3 → 4 | a4 → 4 | a5 → 4 | ..... | |
| S5 | a1 → 5 | a2 → 5 | a3 → 5 | a4 → 5 | a5 → 5 | ..... | |
| S ..... | ..... | ..... | ..... | ..... | ..... | ..... |
Como relacionadas anteriormente, Heisenberg desarrolló formas de relacionarse de manera significativa la información en tablas como éstas de una manera matemática. Empíricamente rellenar los valores de las tablas que involucran cantidades cuántica no es un procedimiento sencillo, ya que cualquier medición realizada en un solo sistema que da un valor, pero tiene el potencial de cambiar otros valores. Así que un gran número de copias idénticas del sistema en cuestión deben estar preparados, y una sola medida de hecho en cada sistema. Múltiples experimentos para determinar las mismas características se hacen, y los resultados se promedian. Incluso entonces, las mediciones exactas de todas las características del sistema tal como aparecerían al mismo tiempo no pueden ser proporcionados por la incertidumbre cuántica. Una determinación exacta del valor de una característica crea necesariamente una incertidumbre en el valor de su correlato. "Ciertos pares de observables simplemente no pueden ser medidos de forma simultánea a un nivel arbitrariamente alto de precisión. " Si las mediciones simultáneas están hechos de características correlacionadas (tales como posición y el momento) en múltiples sistemas idénticos, hay inevitablemente habrá diferencias en las mediciones de tal manera que la diferencia entre sus productos es igual o mayor que  / 2 ".
/ 2 ".
En 1925 Heisenberg publicó un artículo titulado "reinterpretación Quantum-mecánica de las relaciones cinemáticas y mecánicas" en relación a sus descubrimientos. Así terminó la vieja teoría cuántica y comenzó la era de la mecánica cuántica. Papel de Heisenberg dio pocos detalles que puedan ayudar a los lectores en la determinación de la forma en que realmente se las ingenió para conseguir sus resultados para los modelos unidimensionales que usó para formar la hipótesis de que resultó tan útil. En su documento, Heisenberg propuso "descartar toda esperanza de observar cantidades hasta entonces no observables, como la posición y el periodo del electrón" y restringirse estrictamente a las cantidades efectivamente observables. Necesitaba reglas matemáticas para predecir las relaciones realmente observados en la naturaleza, y las reglas que produjo trabajó de manera diferente en función de la secuencia en la que se aplicaron. "Rápidamente se hizo evidente que la no conmutatividad (en general) de las cantidades cinemáticas en la teoría cuántica era la nueva idea técnica realmente esencial en el papel. "
El tipo especial de multiplicación que resultó ser requerido en su fórmula fue descrito más elegantemente utilizando matrices especiales de números llamados matrices . En situaciones normales, no importa en qué orden las operaciones implicadas en la multiplicación se realizan, pero la multiplicación de matrices no conmutan . Esencialmente esto significa que es importante que las operaciones de orden dado se realizan en. Multiplicar la matriz A por la matriz B no es el mismo que multiplicar la matriz B por la matriz A. En símbolos, A × B es en general no es igual a B × A. (Lo importante en la teoría cuántica es que resultó importa si uno mide experimentalmente la velocidad primero y luego mide inmediatamente la posición, o vice-versa.) La convención matriz resultó ser una manera conveniente de organizar la información y haciendo clara la exacta secuencia en la que se debe hacer cálculos, y se refleja en una forma simbólica los inesperados resultados obtenidos en el mundo real.
Heisenberg se acercó a la mecánica cuántica, desde la perspectiva histórica que trata un electrón como una partícula oscilante cargada. Uso de Bohr de esta analogía que ya le había permitido a explicar por qué los radios de las órbitas de los electrones sólo podría asumir ciertos valores. Siguió de esta interpretación de los resultados experimentales disponibles y la teoría cuántica que Heisenberg creado posteriormente que un electrón no podía estar en cualquier posición intermedia entre dos "permitida" órbitas. Por lo tanto los electrones se describieron como "saltar" de órbita en órbita. La idea de que un electrón ahora podría ser en un lugar y un instante después estar en algún otro lugar sin haber viajado entre los dos puntos fue uno de los primeros indicios de la "spookiness" de los fenómenos cuánticos. Aunque la escala es más pequeño, el "salto" de órbita en órbita es tan extraño e inesperado, como sería el caso en el que alguien salió de una puerta en Londres en las calles de Los Ángeles. túnel Quantum es un caso en el que los electrones parecen ser capaz de moverse en el camino "espeluznante" que Heisenberg atribuye a sus acciones dentro de los átomos.
Amplitudes de posición y el impulso que tienen un período de 2  como un ciclo de una onda se llaman variables de series de Fourier. Heisenberg describe las propiedades de partículas como el del electrón en una ola como tener posición y el momento de su mecánica de matrices. Cuando estas amplitudes de posición y el momento se miden y se multiplican entre sí, dan intensidad. Sin embargo, se encontró que cuando la posición y el momento se multiplican entre sí en ese orden respectivo, y luego el impulso y la posición se multiplican entre sí en ese orden respectivo, había una diferencia o desviación en intensidad entre ellas de h / 2
como un ciclo de una onda se llaman variables de series de Fourier. Heisenberg describe las propiedades de partículas como el del electrón en una ola como tener posición y el momento de su mecánica de matrices. Cuando estas amplitudes de posición y el momento se miden y se multiplican entre sí, dan intensidad. Sin embargo, se encontró que cuando la posición y el momento se multiplican entre sí en ese orden respectivo, y luego el impulso y la posición se multiplican entre sí en ese orden respectivo, había una diferencia o desviación en intensidad entre ellas de h / 2  . Heisenberg no entendería la razón de esta desviación hasta que dos años más había pasado, pero por el momento que satisfecho a sí mismo con la idea de que las matemáticas trabajó y proporcionó una descripción exacta del comportamiento cuántico del electrón.
. Heisenberg no entendería la razón de esta desviación hasta que dos años más había pasado, pero por el momento que satisfecho a sí mismo con la idea de que las matemáticas trabajó y proporcionó una descripción exacta del comportamiento cuántico del electrón.
Mecánica matricial fue la primera definición completa de la mecánica cuántica, sus leyes y propiedades que describen completamente el comportamiento del electrón. Se extendió posteriormente a aplicarse a todas las partículas subatómicas. Muy poco después de la mecánica de matrices se introdujo al mundo, Schrödinger, actuando de forma independiente, produjo una teoría de onda cuántica que parecía no tener similitudes en absoluto a la teoría de Heisenberg. Fue computacionalmente más fácil y evita algunas de las ideas y pico sonando como "saltos cuánticos" de un electrón de una órbita a otra. Pero en poco tiempo el propio Schrödinger había demostrado que las dos teorías produjeron esencialmente los mismos resultados en todas las situaciones. Por último, Dirac hizo la idea de la no conmutatividad central para su propia teoría y demostró las formulaciones de Heisenberg y Schrödinger de ser casos especiales de su propia teoría.
Ecuación de onda de Schrödinger

Debido a que las partículas podrían ser descritas como ondas, más tarde en 1925 Erwin Schrödinger analizó lo que un electrón se vería como una onda alrededor del núcleo del átomo. El uso de este modelo, que formuló su ecuación de ondas de partículas. En lugar de explicar el átomo por analogía a los satélites en órbitas planetarias, que todo lo tratado en forma de ondas por el que cada electrón tiene su propia función de onda única. Una función de onda se describe en la ecuación de Schrödinger por tres propiedades (más tarde Wolfgang Pauli añadió un cuarto). Las tres propiedades fueron (1) una designación de "orbital", que indica si la onda de partícula es uno que está más cerca del núcleo con menos energía o uno que está más lejos del núcleo con más energía, (2) la forma de la orbital, es decir, una indicación de que los orbitales no sólo eran esféricas pero otras formas, y (3) el momento magnético del orbital, que es una manifestación de la fuerza ejercida por la carga del electrón a medida que gira alrededor del núcleo.
Estas tres propiedades fueron llamados colectivamente la función de onda del electrón y se dice para describir el estado cuántico del electrón. "Estado cuántico" significa las propiedades colectivas del electrón que describe lo que podemos decir acerca de su estado en un momento dado. Para el electrón, el estado cuántico se describe por su función de onda, que se designa en física por la letra griega  (psi, pronunciado "suspirar"). Las tres propiedades de la ecuación de Schrödinger que describen la función de onda del electrón y, por lo tanto, también describen el estado cuántico del electrón como se describe en el párrafo anterior son cada uno de los llamados números cuánticos. La primera propiedad que describe el orbital fue numerada según el modelo de Bohr, donde n es la letra utilizado para describir la energía de cada orbital. Esto se llama el número cuántico principal. El siguiente número cuántico que describe la forma de la orbital se llama el número cuántico azimutal y se representa por la letra l (L minúscula). La forma es causado por el momento angular de la orbital. La tasa de cambio del momento angular de cualquier sistema es igual al par externa resultante que actúa sobre dicho sistema. En otras palabras, el momento angular representa la resistencia de un objeto que gira para acelerar o ralentizar bajo la influencia de una fuerza externa. El número cuántico azimutal "l" representa el momento angular orbital de un electrón alrededor de su núcleo. Sin embargo, la forma de cada orbital tiene su propia letra también. Así que para la letra "l" hay otras letras para describir la forma de "l" . La primera forma es esférica y se describe por la letra s . La siguiente forma es como una pesa y es descrito por la letra p . Las otras formas de orbitales se vuelven más complicados (ver orbitales atómicos) y se describen por las letras d , f , y g . Para la forma de un átomo de carbono, ver átomo de carbono. El tercer número cuántico de la ecuación de Schrödinger describe el momento magnético del electrón y se designa por la letra m y a veces como la letra m con un subíndice l debido a que el momento magnético depende del segundo número cuántico l .
(psi, pronunciado "suspirar"). Las tres propiedades de la ecuación de Schrödinger que describen la función de onda del electrón y, por lo tanto, también describen el estado cuántico del electrón como se describe en el párrafo anterior son cada uno de los llamados números cuánticos. La primera propiedad que describe el orbital fue numerada según el modelo de Bohr, donde n es la letra utilizado para describir la energía de cada orbital. Esto se llama el número cuántico principal. El siguiente número cuántico que describe la forma de la orbital se llama el número cuántico azimutal y se representa por la letra l (L minúscula). La forma es causado por el momento angular de la orbital. La tasa de cambio del momento angular de cualquier sistema es igual al par externa resultante que actúa sobre dicho sistema. En otras palabras, el momento angular representa la resistencia de un objeto que gira para acelerar o ralentizar bajo la influencia de una fuerza externa. El número cuántico azimutal "l" representa el momento angular orbital de un electrón alrededor de su núcleo. Sin embargo, la forma de cada orbital tiene su propia letra también. Así que para la letra "l" hay otras letras para describir la forma de "l" . La primera forma es esférica y se describe por la letra s . La siguiente forma es como una pesa y es descrito por la letra p . Las otras formas de orbitales se vuelven más complicados (ver orbitales atómicos) y se describen por las letras d , f , y g . Para la forma de un átomo de carbono, ver átomo de carbono. El tercer número cuántico de la ecuación de Schrödinger describe el momento magnético del electrón y se designa por la letra m y a veces como la letra m con un subíndice l debido a que el momento magnético depende del segundo número cuántico l .
En mayo de 1926 Schrödinger publicó una prueba de que la mecánica matricial de Heisenberg y sus propios mecánica ondulatoria dieron resultados equivalentes: matemáticamente que eran la misma teoría. Sin embargo, los dos hombres no estaban de acuerdo sobre la interpretación de esta teoría. Heisenberg vio ningún problema en la existencia de saltos cuánticos discontinuos, mientras Schrödinger espera que una teoría basada en las propiedades de onda continua podría evitar esta "tontería de saltos cuánticos" (en palabras de Wilhelm Wien).
Principio de incertidumbre
En 1927, Heisenberg hizo un nuevo descubrimiento sobre la base de su teoría cuántica que tuvo consecuencias más prácticas de esta nueva forma de ver la materia y la energía en la escala atómica. En la fórmula mecánica matricial de Heisenberg, se encontró con un error o diferencia de h / 2  entre la posición y el momento. Se determina el más seguro de la posición de una partícula, menos seguro de que el impulso se conoce, y h / 2
entre la posición y el momento. Se determina el más seguro de la posición de una partícula, menos seguro de que el impulso se conoce, y h / 2  es el límite inferior de la incertidumbre involucrada. Esta conclusión llegó a ser llamado "Principio de indeterminación de Heisenberg", o de incertidumbre de Heisenberg.
es el límite inferior de la incertidumbre involucrada. Esta conclusión llegó a ser llamado "Principio de indeterminación de Heisenberg", o de incertidumbre de Heisenberg.
Para las partículas en movimiento en la mecánica cuántica, no es más que un cierto grado de exactitud y precisión que falta. El observador puede ser preciso cuando se toma una medición de la posición o puede ser preciso cuando se toma una medición de impulso, pero no existe una imprecisión inversa cuando se mide tanto en el mismo tiempo que en el caso de una partícula en movimiento como el electrón. En el caso más extremo, la precisión absoluta de una variable implicaría imprecisión absoluta con respecto a la otra.
Heisenberg, en una grabación de voz de una conferencia de mañana, el principio de incertidumbre que apunta a un modelo atómico de Bohr, dijo:
- "Se puede decir, bueno, esta órbita no es realmente una órbita completa. En realidad en cada momento el electrón tiene solamente una posición incorrecta y una velocidad incorrecta y entre estos dos inexactitudes hay esta relación de incertidumbre. Y sólo por esta idea que era posible para decir lo que era tal órbita ".
Una consecuencia del principio de incertidumbre era que el electrón ya no podría ser considerado como en una ubicación exacta en su orbital. Más bien, el electrón tenía que ser descrito por cada punto donde el electrón podría habitar. Cálculo de puntos de localización probable para el electrón en su orbital conocida creado la imagen de una nube de puntos en una forma esférica para el orbital de un átomo de hidrógeno, que poco a poco se desvaneció puntos más cerca del núcleo y más lejos del núcleo. Este cuadro puede denominarse una distribución de probabilidad . Por lo tanto, el átomo de Bohr número n para cada orbital llegó a ser conocido como un n-esfera en el átomo de tres dimensiones y se representa como una nube de probabilidad donde el electrón rodeado el átomo de todos a la vez.
Esto condujo a la descripción adicional por Heisenberg que si no estaba siendo tomada una medición del electrón que no podía ser descrito en una ubicación particular, pero estaba en todas partes en la nube de electrones a la vez. En otras palabras, la mecánica cuántica no pueden dar resultados exactos, pero sólo las probabilidades para la ocurrencia de una variedad de posibles resultados. Heisenberg fue más allá y dijo que la trayectoria de una partícula en movimiento sólo llega a existir una vez que observamos. Sin embargo extraño y contrario a la intuición esta afirmación pueda parecer, la mecánica cuántica que hace todavía nos dicen que la ubicación de la órbita, su nube de probabilidad del electrón. Heisenberg estaba hablando de la partícula en sí, no su orbital que está en una distribución de probabilidad conocida.
Es importante tener en cuenta que aunque Heisenberg utiliza conjuntos infinitos de posiciones para el electrón en sus matrices, esto no significa que el electrón podría estar en cualquier lugar en el universo. Más bien hay varias leyes que muestran el electrón debe estar en una distribución de probabilidad localizada. Un electrón es descrito por su energía en el átomo de Bohr, que fue trasladada a la mecánica de matrices. Por lo tanto, un electrón en un cierto n-esfera tenía que estar dentro de un cierto rango del núcleo dependiendo de su energía. Esto restringe su ubicación. Además, el número de plazas de un electrón puede ser también se le llama "el número de células en su espacio de fase ". El principio de incertidumbre establece un límite inferior a la forma en que uno puede picar finamente el espacio fase clásica, por lo que el número de lugares que un electrón puede estar en su órbita se vuelve finita. La ubicación de un electrón en un átomo se define como en su orbital, pero se detiene en el núcleo y antes de la siguiente n-esfera comienza orbital.
La física clásica había mostrado desde Newton que si la posición de las estrellas y los planetas y detalles sobre sus movimientos eran conocidos entonces, ¿dónde van a ser en el futuro se puede predecir. Para las partículas subatómicas, Heisenberg negó esta idea mostrando que, debido al principio de incertidumbre no se puede conocer la posición exacta y el momento de una partícula en un instante dado, por lo que su futuro movimiento no se puede determinar, pero sólo un abanico de posibilidades para el movimiento futuro de la partícula puede ser descrito.
El término estado propio se deriva de la palabra alemana / holandesa "eigen", que significa "inherente" o "característica". La palabra estado propio es descriptivo del estado medido de algún objeto que posee características cuantificables como la posición, impulso, etc. El estado se está midiendo y descrito debe ser un " (es decir, algo observable "que puede ser medido de forma experimental, ya sea directa o indirectamente, como la posición o impulso), y debe tener un valor definido. En el mundo cotidiano, es natural e intuitiva de pensar en todo el ser en su propio estado propio. Todo parece tener una posición definida, un impulso definitivo, un valor definitivo de la medida, y un tiempo definido de ocurrencia. Sin embargo, la mecánica cuántica afirma que es imposible determinar los valores exactos para el impulso de una determinada partícula como un electrón en un lugar determinado en un momento determinado en el tiempo, o, alternativamente, que es imposible dar una ubicación exacta para tal objetar cuando se ha medido el impulso. Debido al principio de incertidumbre, declaraciones con respecto tanto a la posición y el momento de las partículas sólo pueden darse en términos de una gama de probabilidades, una "distribución de probabilidad". La eliminación de la incertidumbre en un término maximiza la incertidumbre en relación con el segundo parámetro.
Por lo tanto se hizo necesario tener una manera de formular claramente la diferencia entre el estado de algo que es incierto en la forma que acabamos de describir, como un electrón en una nube de probabilidad, y efectivamente contrastarlo con el estado de algo que no es incierto, algo que tiene un valor definido. Cuando algo está en la condición de ser definitivamente "abajo clavado" en cierto sentido, se dice que posee un estado propio . Por ejemplo, si la posición de un electrón se ha hecho definido, que se dice que tiene un eigenstate de posición.
Un valor definido, tales como la posición de un electrón que ha sido localizado con éxito, se llama el valor propio de la eigenstate de posición. La palabra alemana "eigen" fue utilizado por primera vez en este contexto por el matemático David Hilbert en 1904. ecuación de onda de Schrödinger da soluciones función de onda, es decir, las posibilidades donde el electrón podría ser, tal como lo hace la distribución de probabilidad de Heisenberg. Como se ha indicado anteriormente, cuando un colapso función de onda se produce porque algo se ha hecho para localizar la posición de un electrón, el estado del electrón se convierte en un estado propio de la posición, lo que significa que la posición tiene un valor conocido.
El principio de exclusión de Pauli
La Principio de Exclusión de Pauli establece que ninguna de electrones (u otrofermiones) pueden estar en el mismo estado cuántico como otro dentro de un átomo.
Wolfgang Pauli desarrolló el Principio de Exclusión de lo que él llama un "grado cuántica de dos valores de la libertad" para dar cuenta de la observación de un doblete, lo que significa un par de líneas, en el espectro del átomo de hidrógeno. La observación significaba que había más energía en el electrón orbital del momento magnético lo que se había descrito. A principios de 1925, los jóvenes físicos Uhlenbeck y Goudsmit introdujeron la teoría de que el electrón gira en el espacio de la misma manera que la Tierra gira sobre su eje. Esto explicaría el momento magnético que falta y permitir dos electrones en el mismo orbital a ser diferente si sus giros fueron en direcciones opuestas, satisfaciendo así el principio de exclusión.
Según la ecuación de Schrödinger, hay tres estados cuánticos del electrón, pero si dos electrones pueden estar en el mismo orbital, tiene que haber otro número cuántico (el grado cuántica de dos valores de libertad) para distinguir los dos electrones de la otra . Un solo electrón no puede tener los mismos cuatro números cuánticos como otro electrón en el mismo orbital atómico. Cuando dos electrones se encuentran en la misma n-esfera y por lo tanto comparten el mismo número cuántico principal, deben entonces tener algún otro número cuántico única de forma l , momento magnético m o giro s . Cuando los electrones no están en un orbital alrededor del núcleo de un átomo, como en la formación de los gases degenerados, que todavía deben seguir el principio de exclusión de Pauli, cuando en un espacio confinado.
Ecuación de onda Dirac
En 1928, Paul Dirac elaboró una variación de la ecuación de Schrödinger que representó una cuarta propiedad del electrón en su orbital. Paul Dirac introdujo el cuarto número cuántico llamado el número cuántico de espín designada por la letra s de la nueva ecuación de Dirac de la función de onda del electrón. En 1930, Dirac combina la mecánica matricial de Heisenberg con la mecánica ondulatoria de Schrödinger en una sola representación mecánica cuántica en sus Principios de la Mecánica Cuántica . La imagen cuántica del electrón ahora estaba completa.
Todo el desarrollo por encima de la teoría cuántica se basó principalmente en el espectro atómico del átomo de hidrógeno. Esto es debido al hecho de que cada átomo de cada elemento produce un único patrón de líneas espectrales cuando la luz de cada tipo diferente de elemento se pasa a través de un prisma. Los científicos no pudieron estudiar el electrón y el núcleo del átomo en sí, ya que no se pueden ver. Incluso hoy en día con la alta resolución de escaneo Tunneling microscopios electrónicos sólo podemos obtener imágenes del átomo como un fuzzball borrosa. Sin embargo, las líneas espectrales del átomo revelan las órbitas de electrones y la energía que se puede esperar. Era básicamente este estudio del análisis espectroscópico de primera el átomo de hidrógeno y luego el átomo de helio que condujo a la teoría cuántica. Por lo tanto, se hicieron las fórmulas matemáticas para adaptarse a la imagen del espectro atómico. Esa es la razón por la mecánica cuántica se refiere a veces como una forma de la física matemática.
Entrelazamiento cuántico
Albert Einstein rechazó Principio de Incertidumbre de Heisenberg en la medida en que parecía implicar más de una limitación necesaria en la capacidad humana de conocer realmente lo que ocurre en el reino cuántico. En una carta a Max Born en 1926, Einstein pronunció la célebre frase de que "Dios no juega a los dados". La prescripción nivel de superficie desnuda para hacer predicciones de la mecánica cuántica, basado en la regla de Born para el cálculo de probabilidades, se hizo conocida como la interpretación de Copenhague de la mecánica cuántica. Bohr pasó muchos años en el desarrollo y el perfeccionamiento de esta interpretación a la luz de las objeciones de Einstein. Después del 1930 Conferencia Solvay, Einstein nunca jamás cuestionó la interpretación de Copenhague sobre puntos técnicos, pero no cesó un ataque filosófico sobre la interpretación, sobre la base del realismo y localidad. Einstein, en tratar de demostrar que la teoría cuántica no era una teoría completa, reconoció que la teoría predice que dos o más partículas que han interactuado en el pasado pueden mostrar correlaciones fuertes cuando varias mediciones se realizan en ellos. Él quería que esto se explica de una manera clásica a través de su pasado común, y preferiblemente no por una "espeluznante acción a distancia ". El argumento se trabajó en un famoso artículo dedicado a lo que ahora se llama la paradoja EPR (Einstein-Podolsky-Rosen, 1935). Suponiendo que lo que hoy se suele llamar " realismo local ", el EPR intenta mostrar de la teoría cuántica que las partículas poseen simultáneamente posición y el momento, mientras que, según la interpretación de Copenhague, sólo una de estas dos propiedades existe sólo brevemente, en el momento en que que se está midiendo. Einstein consideraba esta conclusión una prueba de que la teoría cuántica era incompleta ya que se niega a hablar sobre propiedades físicas que existen objetivamente en la naturaleza. La característica de la teoría cuántica que lleva a estas paradojas es llamado entrelazamiento cuántico. Esto significa que las propiedades de varios objetos separados no pueden ser descritos por considerar por separado, incluso después de tener en cuenta la historia de su interacción pasado. El documento de 1935 de Einstein, Podolsky y Rosen es actualmente publicación más citada de Einstein en revistas de física.
Respuesta original de Bohr a Einstein era que las partículas eran parte de un sistema indivisible. Desafío de Einstein llevó a décadas de investigación sustancial en el entrelazamiento cuántico. La investigación parece confirmar la objeción de Bohr que las dos partículas entrelazadas deben considerarse en conjunto como un todo, y por otra parte, que las dificultades sólo surgen al insistir en la realidad de los resultados de las mediciones que no se hacen de todos modos. Por otra parte, Dios hace tirar los dados, aunque los más peculiares. Un tiro de dados real puede ser completamente entendida con la mecánica clásica, y el resultado es simplemente una función de las condiciones iniciales. Sin embargo el resultado de lanzar los dados cuánticos no tiene antecedente; ninguna causa o explicación en absoluto.
Interpretaciones
De acuerdo con la principio de correspondencia y el teorema de Ehrenfest como un sistema se hace más grande o más masiva ( acción >> h ) la dinámica clásica tiende a surgir, con algunas excepciones, como superfluidez. Esta es la razón por lo general podemos ignorar la mecánica cuántica cuando se trata de objetos de uso cotidiano; en lugar de la descripción clásica será suficiente. Aun así, tratando de dar sentido a la teoría cuántica es un proceso continuo que ha dado lugar a una serie de interpretaciones de la teoría cuántica, que van desde lo convencional interpretación de Copenhague de variables ocultas y muchos mundos. No parece haber ningún final a la vista de las reflexiones filosóficas sobre el tema; sin embargo, el éxito empírico o técnica de la teoría no tiene rival; todas las teorías físicas fundamentales son modernas teorías cuánticas, la relatividad de ser subsumidos dentro de las teorías cuánticas de campos.